Цель работы
1. Освоить методику определения величины адсорбции поверхностью твердого тела.
2. Определить константы уравнения Фрейндлиха для случая адсорбции уксусной кислоты активированным углём из водных растворов.
Адсорбционное равновесие. Изотерма адсорбции.
С кинетической точки зрения адсорбция является обратимым процессом, т.е. одновременно с адсорбцией происходит десорбция, когда адсорбированные молекулы вследствие кинетического движения уходят с поверхности адсорбента в газовую фазу или раствор. В начале процесса скорость адсорбции больше скорости десорбции. По мере насыщения поверхности адсорбента устанавливается состояние адсорбционного равновесия, которое характеризуется равенством скоростей адсорбции и десорбции. Концентрация вещества в газовой фазе или растворе, отвечающая состоянию равновесия называется равновесной. Адсорбционное равновесие подвижно и может быть смещено в ту или другую сторону в соответствии с принципом Ле Шателье.
Количественно адсорбцию можно выражать в молях адсорбата на единицу площади поверхности адсорбента, моль/м2, или на единицу массы адсорбента, моль/г. Кривую зависимости величины адсорбции Г от равновесных концентрации С или давления P адсорбата при постоянной Т называют изотермой адсорбции: Г = f (С) или Г = f(P) при Т = const.
На рис.1 приведены изотермы адсорбции аммиака активированным углём при разных температурах.
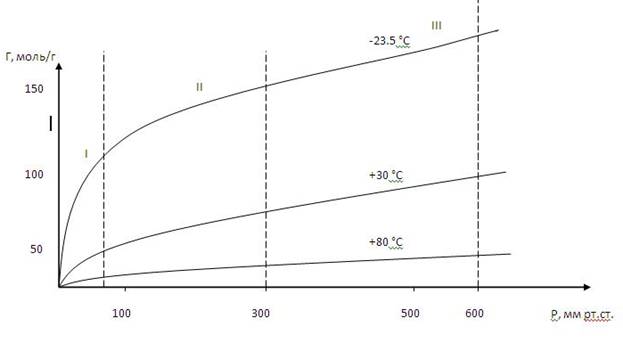
Рис.1 Изотерма адсорбции аммиака на активированном угле.
На кривой, характеризующей адсорбцию при t = -23,50C, можно выделить три участка: I – адсорбция прямо пропорциональна давлению газа;
II – адсорбция растет с повышением давления;
III – адсорбция стремится к насыщению.
Как видно из рис. 1, при повышении температуры наблюдается понижение адсорбции, что свидетельствует об экзотермичности процесса.
Требования техники безопасности.
При выполнении работы следует выполнять общие правила работы в химической лаборатории. При отборе кислоты мерными пипетками пользуйтесь грушами! Избегайте попадания растворов кислоты или щелочи на руки и одежду. При необходимости смывайте растворы большим количеством воды и нейтрализуйте раствором слабой кислоты или щелочи.
Экспериментальная часть.
Величина адсорбции на твердых поверхностях измеряется по разности между начальной концентрацией вещества в растворе и концентрацией его при установлении адсорбционного равновесия – равновесной. Так как величина адсорбирующей поверхности обычно неизвестна, поэтому величину адсорбции относят к единице массы адсорбента.
С учетом сказанного, для определения констант в уравнении Фрейндлиха выполните следующее:
1. В пять- восемь конических колб отмерьте мерным цилиндром по 50 мл раствора уксусной кислоты разных концентраций.
2. В каждую из них добавьте по 1 г активированного угля.
3. Для установления адсорбционного равновесия колбы периодически встряхивайте в течение10 = 15 минут.
4. Отфильтруйте растворы в чистые колбы, используя складчатые фильтры.
Таблица 1
| Исходная кислота (по 50 мл) | Кислота после адсорбции | |||||||
| № | Концентрация кислоты, моль/л | Точная концентрация Cо, моль/л | Объем кислоты Vк,мл | Объем щелочи, израсходованный на титрование,мл | Равновесная концентрация кислоты С,моль/л | |||
| V1щ | V2щ | V3щ | Средний объем Vщ | |||||
5. Определите равновесную концентрацию кислоты. Для этого 10 мл фильтрата каждой кислоты оттитруйте раствором 0,1 Н NaOH и проведите расчеты по закону эквивалентов.
С(кислоты) ∙ V(кислоты) = Сн(NaOH) ∙ Vщ сред.(NaOH)
Результаты внесите в таблицу 1.
6. Для определения коэффициентов Kc и 1/n в уравнении Фрейндлиха представим его в логарифмическом виде:
lg Г = lgКс + 1/n lg С
Это уравнение есть уравнение первой степени, графическое изображение которого даёт прямую линию в координатах: lg Г = f (lg C).
Для построения графика (общий вид которого показан на рис.2), заполните таблицу 2.
Таблица 2
| № | Точная концентрация исходного раствора кислоты Со (моль/л | Равновесная концентрация кислоты | Количество адсорбированной кислоты, (моль) х = 0,05∙(Со - С) | Масса адсорбента m, г | Величина адсорбции (моль/г) | ||
| С, моль/л | lg C | Г=х/m | lg Г | ||||
7. По графику (рис.2) определите постоянные и запишите уравнение изотермы, для исследованного случая: Г = Кс∙С1/n
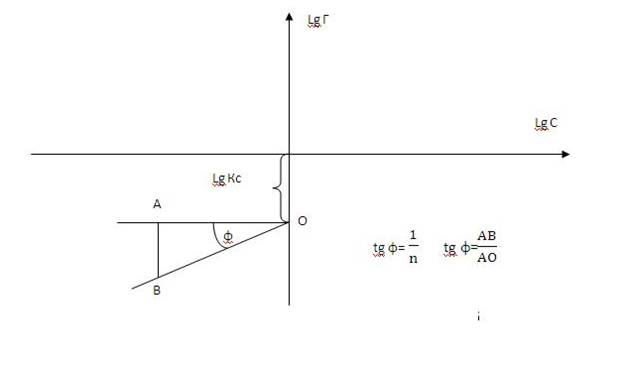
Рис.2 Изотерма адсорбции в логарифмических координатах.
8. По экспериментальным данным постройте график изотермы адсорбции в координатах Г = f (С равнов).
9. Для сравнения на последнем графике постройте теоретическую изотерму адсорбции, предварительно рассчитав величину адсорбции по полученному экспериментальному уравнению приняв равновесные концентрации уксусной кислоты равными: 0,05; 0,1; 0,15; 0,2 и 0,3 моль/л.
Оформление работы.
1. Название работы.
2. Цель работы.
3. Привести все расчеты. Экспериментальные результаты представьте в виде таблиц и графически(2 таблицы и 2 графика). Графики надо строить по экспериментальным (или рассчитанным) точкам.
4. Вывод.
Контрольные вопросы.
1. Что такое адсорбция? Причины её протекания и виды адсорбции.
2. Единицы измерения адсорбции.
3. Что характеризует адсорбционное равновесие? Как влияют на него концентрация адсорбата и температура?
4. Изотерма адсорбции. Уравнение Лэнгмюра и Фрейндлиха.
5. В чём принципиальное различие между уравнениями Лэнгмюра и Фрейндлиха?
6. Найти равновесную концентрацию уксусной кислоты если величина адсорбции в уравнении Фрейндлиха равна 0,012 моль/м2, а константа Кс и n соответственно 0,25 и 3,1.
7. Теплота адсорбции аммиака на мелко раздробленной меди равна 29,3 кДж. Какой объем аммиака поглотится медью, если при этом выделилось 158,6 кДж тепла?
Литература
1. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов/ Ю.А.Ершов, В.А.Попков, А.С.Берменд и др.: - Учеб.для мед.спец.вузов. Под.ред. Ю.А.Ершова. - М.: Высш.шк.., 1993. - 560 с., ил.
2. Слесарев В.И.Химия: Основы Химии живого: Учебник для вузов – 2-е изд. испр и доп. – СПб: Химиздат, 2001. –780 с.: ил.
3. Коровин В.Н Общая химия. – М.: ВШ., 1998 (2002). - 559 с
4. Глинка Н.Л. Общая химия. - М.: Химия, 1988. - 720 с. (М.: Интеграл-Пресс, 2002. – 727 с.).