Изомеры и гомологи
| г о м о л о г и | CH4 метан | |||
| CH3—CH3 этан | ||||
| CH3—CH2—CH3 пропан | ||||
| CH3—(CH2)2—CH3 бутан | 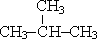 2-метилпропан 2-метилпропан
| |||
| CH3—(CH2)3—CH3 пентан | 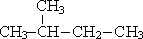 2-метилбутан 2-метилбутан
| 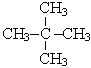 2,2-диметилпропан 2,2-диметилпропан
| ||
| CH3—(CH2)4—CH3 гексан |  2-метилпентан 2-метилпентан
| 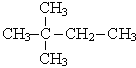 2,2-диметилбутан 2,2-диметилбутан
|  2,3-диметилбутан 2,3-диметилбутан
|  3-метилпентан 3-метилпентан
|
| и з о м е р ы |
Физические свойства алканов
При комнатной температуре С1-C4 - газы, C5-C15 - жидкости, C16 и следующие - твердые вещества; нерастворимы в воде; плотность меньше 1 г/см3; жидкие - с запахом бензина.
С увеличением числа атомов углерода в молекуле возрастает температура кипения.
Химические свойства алканов
Малоактивны в обычных условиях, не реагируют с растворами кислот и щелочей, не обесцвечивают раствор KMnO4 и бромную воду.
1. Горение (окисление с разрывом связей C—C и C—H): CH4 + 2O2  CO2 + 2H2O + Q
CO2 + 2H2O + Q
2. Замещение (с разрывом связей C—H):
а) галогенирование (только с хлором и с бромом):
1-я стадия: CH4 + Cl2  CH3Cl + HCl (при нагревании или на свету).
CH3Cl + HCl (при нагревании или на свету).
При достаточном количестве галогена происходит дальнейшее замещение атомов водорода:
| CH3Cl хлорметан | + Cl2 
| CH2Cl2 дихлорметан | + HCl, |
CH2Cl2 + Cl2 
| CHCl3 трихлорметан | + HCl, |
CHCl3 + Cl2 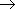
| CCl4 тетрахлорметан | + HCl. |
б) нитрование (реакция Коновалова):
CH4 + HONO2 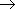
| CH3NO2 нитрометан | + H2O (при нагревании) |
Получение алканов
Лабораторные способы:
1. Гидролиз карбида алюминия (получение метана): Al4C3 + 12H2O 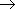 4Al(OH)3 + 3CH4
4Al(OH)3 + 3CH4 
2. Реакция обмена: CH3COONa + NaOH 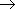 Na2CO3 + CH4
Na2CO3 + CH4 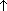 (при нагревании)
(при нагревании)
3. Реакция Вюрца: 2CH3Cl + 2Na 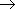 CH3—CH3 + 2NaCl
CH3—CH3 + 2NaCl
Промышленные способы:
1. Выделение из природных источников (природного газа, нефти, каменного угля, горючих сланцев).
2. Газификация твердого топлива: C + 2H2 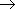 CH4 (при нагревании под давлением в присутствии Ni-катализатора)
CH4 (при нагревании под давлением в присутствии Ni-катализатора)
Циклоалканы - предельные углеводороды, состав которых выражается формулой C n H2 n . В состав молекул циклоалканов входят замкнутые углеродные цепи (циклы).
Изомеры и гомологи
| г о м о л о г и | Циклопропан C3H6 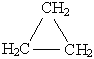 или или 
| |||
Циклобутан C4H8 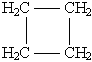 или или 
| Метилциклопропан 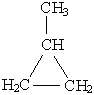
| |||
Циклопентан C5H10 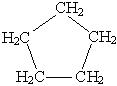 или или 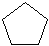
| Метилциклобутан 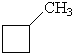
| 1,1-диметилциклопропан 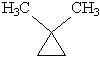
| 1,2-диметилциклопропан 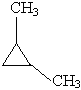
| Этилциклопропан 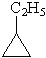
|
| и з о м е р ы |
Упрощенно углеводородный цикл часто изображают правильным многоугольником с соответствующим числом углов.
Физические свойства мало отличаются от свойств алканов.
Химические свойства
За исключением циклопропана и циклобутана циклоалканы, как и алканы, малоактивны в обычных условиях.
Общие свойства циклоалканов (на примере циклогексана):
1. горение (окисление с разрывом связей C—C и C—H):
C6H12 + 9O2  6CO2 + 6H2O + Q
6CO2 + 6H2O + Q
2. замещение (галогенирование, нитрование):
C6H12 + Cl2  C6H11Cl + HCl (при нагревании или на свету)
C6H11Cl + HCl (при нагревании или на свету)
3. присоединение (гидрирование):
C6H12 + H2  C6H14 (при нагревании под давлением в присутствии Ni-катализатора)
C6H14 (при нагревании под давлением в присутствии Ni-катализатора)
4. разложение (дегидрирование, крекинг, пиролиз):
C6H12 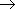 C6H6 + 3H2 (при нагревании с катализатором).
C6H6 + 3H2 (при нагревании с катализатором).
Особые свойства циклопропана и циклобутана (склонность к реакциям присоединения):
1. галогенирование:
 + Br2
+ Br2 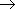 BrCH2—CH2—CH2Br
BrCH2—CH2—CH2Br
2. гидрогалогенирование:
 + HBr
+ HBr 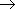 CH3—CH2—CH2Br
CH3—CH2—CH2Br
Способы получения циклоалканов
1. Выделение из природных источников (нефть, природный газ).
2. Дегидрирование алканов:
| CH3—CH2—CH2—CH2—CH2—CH3 | 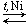
| 
| + H2 |
3. Дегалогенирование галогеналканов:
Br—CH2—CH2—CH2—CH2—Br + Zn 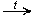
| 
| + ZnBr2 |
4. Гидрирование ароматических углеводородов:
| C6H6 + 3H2 | 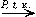
| C6H12 |