Предельные углеводороды (алканы)
Предельными (насыщенными) углеводородами, или алканами, называют углеводороды, в молекулах которых все валентности атомов углерода, не участвующие в образовании простых углерод-углеродных связей С-С, насыщены атомами водорода.
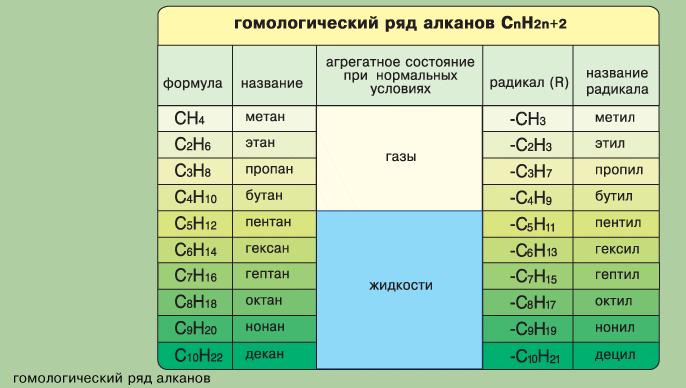
Предельные углеводороды образуют гомологический ряд – ряд веществ, сходных по строению и свойствам, но отличающихся по составу на одну или несколько групп атомов –СН2-. Вещества такого ряда называют гомологами.
Метан и его газообразные гомологи (этан, пропан, бутан) содержаться в природном и попутном нефтяном газе. Жидкие алканы – основная составная часть нефти. Твердые предельные углеводороды (парафин) растворены в нефти, которая и служит источником их получения.
Общая формула алканов СnН2n+2
Если от молекулы алкана мысленно отщепить один атом водорода, получим частицу со свободной валентностью атома углерода; ее называют радикалом. Название радикала по сравнению с названием соответствующего предельного углеводорода тоже изменяется: суффикс –ан заменяется на –ил.
Формулы и названия радикалов нужно знать для того, чтобы уметь называть органические вещества, имеющие разветвленный углеродный скелет. Помимо алканов с линейной цепью существуют изомеры с разветвленным углеродным скелетом (для алканов характерна изомерия углеродного скелета). Так для бутана С4Н10 возможен различный порядок строения молекул: в виде линейной цепи и разветвленной:
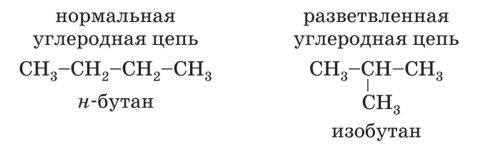
В соответствии с требованиями международной номенклатуры названия алканам следует давать по следующим правилам:
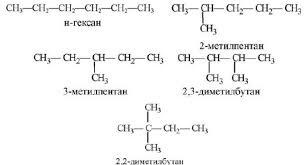
1. Выбирают в молекуле самую длинную цепочку атомов углерода.
2. Нумеруют атомы углерода в цепочке с того конца, к которому ближе разветвление.
3. Записывают основу названия вещества – название алкана с тем же числом углеродных атомов, что и в пронумерованной цепи.
4. Перед основой названия перечисляют все заместители основной цепи с указанием номеров атомов углерода, при которых они стоят. Если одинаковых заместителей несколько, перед их названиями указывают ди-, три-, тетра-, пента- и т.д.
5. Все цифры отделяют друг от друга запятыми, буквы от цифр – дефисами. Если при одном углеродном атоме имеется не один, а два заместителя, его цифру повторяют в названии дважды.
6. Перед названием предельного углеводорода нормального (неразветвленного) строения ставят букву н-.
 1 2 3 4 5
1 2 3 4 5
СН3-СН2- СН2- СН2-СН3
н – пентан
Химические свойства алканов
1. Горение – это реакция, протекающая с выделением тепла и света. При горении углеводородов образуются углекислый газ и вода.
CH4 + 2O2 → CO2 + 2H2O
Метан
2C2H6 + 7O2 → 4CO2 + 6H2O
Этан
Горение предельных углеводородов широко используется в быту, промышленности, технике. Следует помнить, что углеводороды являются пожароопасными и взрывоопасными веществами. Утечка бытового газа грозит страшными последствиями. Чтобы вовремя обнаружить наличие в воздухе бытового газа, к нему добавляют вещества с резким неприятным запахом – меркаптаны. Если вы почувствовали на кухне, в подъезде или на улице запах газа, следует немедленно обратиться в специализированную службу, проветрить помещение и не пользоваться открытым огнем или электроприборами.
Примерно 90% добываемого углеводородного сырья используется в качестве топлива. Оставшиеся 10% - чрезвычайно важное сырье для химической промышленности.
2. В алканах атомы водорода способны замещаться на другие атомы или группы, в частности на атомы галогенов (хлора и брома). Эта реакция протекает при освещении смеси газообразных реагентов.
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия);
метан хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
тетрахлорметан
Галогенопроизводные предельных углеводородов - прекрасные растворители, хладагенты (рабочие жидкости, которыми заправляют холодильники), реагенты для химического синтеза.
3. При нагревании в присутствии катализатора алканы способны вступать в реакции отщепления.
Дегидрирование - реакция, при которой от молекулы органического вещества отщепляется молекула водорода.
СН3 - СН3 → СН2=СН2 + Н2
Этан Этилен
4. Если предельные углеводороды нагревать без доступа воздуха при более высокой температуре, они разлагаются. Например, из метана при нагревании выше 1000 градусов образуется два ценных продукта – сажа (углерод) и водород.
СН4→ С + Н2
Сажа, полученная таким образом, используется для изготовления автомобильных шин, и резины, входит в состав красок и туши.
Задания
1. Какие вещества называются предельными углеводородами? Укажите их общую формулу.
2. Напишите структурные формулы следующих углеводородов:
а) н-гептан;
б) 2- метилгексан;
в) 3-этилпентан;
г) 2,3 – диметилпентан;
д) 2,3,4 – триметилгексан.
3. Назовите вещества согласно международной номенклатуре:
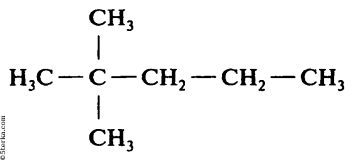 а) СН3-СН2-СН3; в)
а) СН3-СН2-СН3; в)
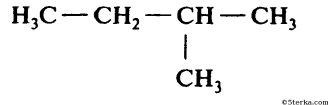 б)
б)
3. Напишите формулы двух гомологов и двух изомеров н-пентана. Назовите эти углеводороды.
4. Охарактеризуйте химические свойства алканов: горение, замещение, дегидрирование, разложение.
5. Опишите области применения алканов на основе их свойств.
6. Тест (задания с выбором одного ответа)
1. Элемент - основа органических веществ:
а) углерод; б) водород; в) кислород.
2. Названия предельных углеводородов:
а) алканы; б) алкены; в) алкины; г) алкадиены.
3. Вещества одного состава, но разные по строению и свойствам:
а) гомологи; б) изомеры.
4. Вещества сходные по строению и свойствам, но отличающиеся по составу молекул на одну или несколько групп СН2:
а) гомологи; б) изомеры.
5. Реакция отщепления водорода:
а) дегидратация; б) дегидрирование.