| № п/п | Вопросы | |||
| Выберите один правильный ответ | ||||
| Растворы. Способы выражения концентрации растворов. | ||||
| 1. | РАСТВОР – ЭТО ГОМОГЕННАЯ СИСТЕМА: 1) постоянного состава, состоящая из двух и более компонентов; 2) переменного состава, состоящая из двух компонентов 3) переменного состава, состоящая из двух и более компонентов. | |||
| 2. | РАСТВОРИТЕЛЬ – ЭТО КОМПОНЕНТ, АГРЕГАТНОЕ СОСТОЯНИЕ КОТОРОГО ПРИ ОБРАЗОВАНИИ РАСТВОРА: 1) не изменяется; 2) изменяется; 3) концентрация которого больше; 4) концентрация которого меньше; 5) концентрация которого постоянна. | |||
| 3. | РАСТВОРЕННОЕ ВЕЩЕСТВО – ЭТО КОМПОНЕНТ, АГРЕГАТНОЕ СОСТОЯНИЕ КОТОРОГО ПРИ ОБРАЗОВАНИИ РАСТВОРА: 1) может не изменяться; 2) не изменяется; 3) концентрация которого в растворе больше; 4) концентрация которого в растворе меньше. | |||
| 4. | КОЛИЧЕСТВО ВЕЩЕСТВА (МОЛЬ) В ОДНОМ ЛИТРЕ РАСТВОРА - ЭТО 1) молярность; 2) моляльность; 3) титр; 4) нормальность; 5) мольная доля. | |||
| 5. | КОЛИЧЕСТВО ВЕЩЕСТВА (МОЛЬ) В 1 КГ РАСТВОРИТЕЛЯ 1) молярность; 2) моляльность; 3) титр; 4) массовая доля; 5) нормальность. | |||
| 6. | МАССА ВЕЩЕСТВА В ГРАММАХ, СОДЕРЖАЩАЯСЯ В 100 Г РАСТВОРА - ЭТО 1) молярность; 2) моляльность; 3) титр; 4) массовая доля; 5) нормальность. | |||
| 7. | МАССА ВЕЩЕСТВА, СОДЕРЖАЩАЯСЯ В 1 МЛ. РАСТВОРА - ЭТО 1) молярность; 2) моляльность; 3) титр; 4) массовая доля; 5) нормальность. | |||
| 8. | РАСТВОР, СОДЕРЖАЩИЙ 0,89 % NaCl ОЗНАЧАЕТ, ЧТО 1) в 100 г раствора содержится 0,89 г NaCl; 2) в 100 мл раствора содержится 0,89 г NaCl; 3) в 1л раствора содержится 0,89 г NaCl; 4) в 1 кг растворителя содержится 0,89 г NaCl; 5) в любой массе раствора содержится 0,89 г NaCl. | |||
| 9. | РАСТВОР ГЛЮКОЗЫС МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ 3 МОЛЬ/Л ОЗНАЧАЕТ, ЧТО 1) в 1 л раствора содержится 3 моль глюкозы; 2) в 100 мл раствора содержится 3 моль глюкозы; 3) в 1 кг раствора содержится 3 моль глюкозы; 4) в 100 г раствора содержится 3 моль глюкозы; 5) в 1 мл раствора содержится 0,3 моль глюкозы. | |||
| 10. | РАСТВОР H2SO4 С МОЛЯРНОЙ КОНЦЕНТРАЦИЕЙ ЭКВИВАЛЕНТА 0,25 Н ОЗНАЧАЕТ, ЧТО 1) в 1 л раствора содержится 0,25 моль H2SO4; 2) в 1 кг растворителя содержится 0,25 моль эквивалента H2SO4; 3) в 1 л раствора содержится 0,25 моль эквивалента H2SO4; 4) в 1 л растворителя содержится 0,25 моль H2SO4; 5) в 2 л раствора содержится 0,25 моль H2SO4 | |||
| 11. | ФАКТОР ЭКВИВАЛЕНТНОСТИ AL(OH)3 В РЕАКЦИИ Al(OH)3 + 3HCl → … РАВЕН … 1) 1/3; 2) 1/2; 3) 1/6; 4) 2; 5) 3. | |||
| 12. | ФАКТОР ЭКВИВАЛЕНТНОСТИ H3PO4 В РЕАКЦИИ H3PO4 + 3NaOH → … РАВЕН … 1) 1/3; 2) 1/2; 3) 1/6; 4) 2; 5) 3. | |||
| 13. | ФАКТОР ЭКВИВАЛЕНТНОСТИ Ca(OH)2 В РЕАКЦИИ Ca(OH)2 + 2HCl → … РАВЕН … 1) 1/3; 2) 1/2; 3) 1/6; 4) 2; 5) 3 | |||
| Объемный анализ. Титрование. | ||||
| 14. | ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ – ЭТО МЕТОД КОЛИЧЕСТВЕННОГО АНАЛИЗА ОСНОВАННЫЙ НА 1) точном измерении объема раствора определяемого вещества; 2) точном измерении объема раствора – титранта; 3) определении массы раствора реагента; 4) определении массы определяемого вещества; 5) определении плотности раствора. | |||
| 15. | ОСНОВОЙ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА ЯВЛЯЕТСЯ ЗАКОН 1) сохранения массы; 2) кратных отношений; 3) эквивалентов; 4) постоянства состава; 5) Авогадро. | |||
| 16. | МЕТОД НЕЙТРАЛИЗАЦИИ ОСНОВАН НА РЕАКЦИИ 1) кислотно-основного взаимодействия; 2) окислительно-восстановительной; 3) осаждения; 4) комплексообразования; 5) гидрирования | |||
| 17. | ТИТРАНТ – ЭТО 1) раствор реагента с точно известной концентрацией; 2) химически чистое вещество; 3) раствор реагента с неизвестной концентрацией; 4) смесь веществ; 5) растворитель. | |||
| 18. | СКАЧОК ТИТРОВАНИЯ – ЭТО 1) резкое изменение рН среды в области точки нейтральности; 2) изменение рН среды от добавления небольшой порции титранта; 3) изменение окраски индикатора от добавления небольшой порции титранта; 4) резкое изменение рН среды в области точки эквивалентности; 5) изменение окраски без добавления индикатора. | |||
| 19. | РЕАКЦИЯ, ЛЕЖАЩАЯ В ОСНОВЕ АЛКАЛИМЕТРИИ 1) Н++ОН-=Н2О; 2) 2Н++СО32-=Н2О+СО2; 3) MnO4-+8H+=Mn2++4H2O; 4) Ca2++CO32-=CaCO3; 5) Ba2++CO32-=BaCO3. | |||
| 20. | ЦВЕТ УНИВЕРСАЛЬНОГО ИНДИКАТОРА В КИСЛОЙ СРЕДЕ 1) красный; 2) желтый; 3) синий; 4) оранжевый; 5) фиолетовый | |||
| 21. | МЕТОД НЕЙТРАЛИЗАЦИИ ОСНОВАН НА РЕАКЦИИ 1) замещения; 2) соединения; 3) обмена; 4) разложения; 5) экзотермической | |||
| 22. | СРЕДА, В КОТОРОЙ ФЕНОЛФТАЛЕИН МЕНЯЕТ ОКРАСКУ 1) кислая; 2) нейтральная; 3) сильнощелочная; 4) сильнокислая; 5) слабокислая. | |||
| Коллигативные свойства растворов | ||||
| 23. | КОЛЛИГАТИВНЫЕ СВОЙСТВА - ЭТО 1) осмотическое давление; 2) давление; 3) температура; 4) ионная сила; 5) рН растворов | |||
| 24. | КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ ЗАВИСЯТ ОТ 1. природы растворителя; 2. температуры; 3. числа частиц растворенного веществ; 4. давления | |||
| 25. | ОДНОСТОРОННЕЕ ДВИЖЕНИЕ МОЛЕКУЛ РАСТВОРИТЕЛЯ ЧЕРЕЗ ПОЛУПРОНИЦАЕМУЮ МЕМБРАНУ ПОД ДЕЙСТВИЕМ РАЗНОСТИ КОНЦЕНТРАЦИЙ - ЭТО 1) броуновское движение; 2) диффузия; 3) осмос; 4) хаотическое движение | |||
| 26. | РАСТВОРЫС ОДИНАКОВЫМ ОСМОТИЧЕСКИМ ДАВЛЕНИЕМ 1) изотонические; 2) гипертонические; 3) гипотонические; 4) насыщенные; 5) пересыщенные | |||
| 27. | Изотонический коэффициент больше 1 для раствора 1) мочевина; 2) C2H5OH; 3) глюкоза; 4) сахароза; 5) Cu(NO3)2 | |||
| 28. | РАСТВОР NaCl, ИЗОТОНИЧНЫЙ КРОВИ ЧЕЛОВЕКА 1. 0,9%; 2. 1,1%; 3. 1,3%; 4. 1,5%; 5. 1,7% | |||
| 29. | ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ ПРОПОРЦИОНАЛЬНО 1) молярной концентрации; 2) моляльной концентрации; 3) молярной концентрации эквивалента; 4) молярной доле; 5) массовой доле | |||
| 30. | ДАВЛЕНИЕ ПАРА НАД РАСТВОРОМ 1) увеличивается; 2) уменьшается; 3) не изменяется | |||
| 31. | ТЕМПЕРАТУРОЙ КИПЕНИЯ ЖИДКОСТИ ЯВЛЯЕТСЯ ТЕМПЕРАТУРА, ПРИ КОТОРОЙ ДАВЛЕНИЕ ПАРА НАД НЕЙ СТАНОВИТСЯ 1) равным внешнему давлению; 2) больше внешнего давления; 3) меньше внешнего давления; 4) температура кипения не зависит от внешнего давления | |||
| 32. | ПОВЫШЕНИЕ ТЕМПЕРАТУРЫКИПЕНИЯ И ПОНИЖЕНИЕ ТЕМПЕРАТУРЫЗАМЕРЗАНИЯ РАСТВОРА ПРОПОРЦИОНАЛЬНО 1) молярной концентрации; 2) молярной концентрации эквивалента; 3) моляльной концентрации; 4) молярной доле; 5) массовой доле | |||
| 33. | Криоскопические и эбуллиоскопические.константы зависят от 1) природы растворителя; 2) температуры; 3) природы растворенного вещества; 4) концентрации; 5) давления. | |||
| 34. | ПРИ ПОМЕЩЕНИИ КЛЕТОК В ГИПЕРТОНИЧЕСКИЙ РАСТВОР НАБЛЮДАЕТСЯ 1) плазмолиз; 2) лизис; 3) гемолиз; 4) клетка не изменяется | |||
| 35. | ПРИ ПОМЕЩЕНИИ КЛЕТОК В ГИПОТОНИЧЕСКИЙ РАСТВОР НАБЛЮДАЕТСЯ 1) плазмолиз; 2) лизис; 3) гемолиз; 4) клетка не изменяется | |||
| 36. | Закон Рауля 1) Pосм.=СRT; 2) (P0-P)P0=x 3) Δtкип.=ЕСm; 4) Δtкр.=КСm | |||
| 37. | Сильный электролит: 1) H2SO4 (к.); 2) H2SO4 (p).; 3) CH3COOH; 4) HCOOH; 5) H3PO4 | |||
| 38. | ЗАКОН ВАНТ-ГОФФА ДЛЯ НЕЭЛЕКТРОЛИТОВ 1) Pосм=CmRT; 2) Pосм=CмRT; 3) Pосм=wRT; 4) Pосм=iCmRT; 5) Pосм=iCмRT | |||
| 39. | ЗАКОН РАЗВЕДЕНИЯ ОСТВАЛЬДА
1) α=К/С;
2) α=К∙С;
3) α= 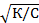 ;
4) α= ;
4) α= 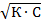 ;
5) α= С/К ;
5) α= С/К
| |||
| 40. | РЕАКЦИЯ НЕОБРАТИМА 1) CuCl2+Na2SO4; 2) HCl+NaCl; 3) BaCl2+HNO3; 4) BaCl2+CH3COOH; 5) Cu(NO3)2+HCl | |||
| 41. | ЗАКОН ВАНТ-ГОФФА ДЛЯ ЭЛЕКТРОЛИТОВ 1) Pосм=iCRT; 2) Pосм=CRT; 3) Pосм=iwRT; 4) Pосм=C/RT; 5) Pосм=CmRT | |||
| 42. | СЛАБЫЕ ЭЛЕКТРОЛИТЫ 1) α>40%; 2) α>30%; 3) α>3%; 4) α<3%; 5) α>50% | |||
| 43. | Сокращенное ионное уравнение H++OH¯→H2O соответствует реакции 1) HCl+Al(OH)3; 2) HCl+Na2CO3; 3) HCl+NaHCO3; 4) HCl+Cu(OH)2; 5) HCl+NaOH | |||
| 44. | ИОННАЯ СИЛА РАСТВОРА РАССЧИТЫВАЕТСЯ ПО ФОРМУЛЕ
1) I=  (С1 (С1  + C2 + C2 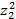 +…);
2) I= +…);
2) I=  (С1 (С1  + C2 + C2 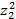 +…);
3) I= +…);
3) I=  (ω1 (ω1  + ω2 + ω2 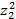 +…);
4) I= α(С1 +…);
4) I= α(С1  + C2 + C2 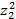 +…);
5) I=С1 +…);
5) I=С1  + C2 + C2 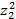 +…; +…;
| |||
| 45. | ПЛАЗМОЛИЗ НЕ ВЫЗЫВАЮТ РАСТВОРЫ 1) насыщенные; 2) ненасыщенные; 3) изотонические; 4) гипотонические; 5) гипертонические | |||
| 46. | ДОЛЯ МОЛЕКУЛ ЭЛЕКТРОЛИТА, РАСПАВШИХСЯ НА ИОНЫ 1) мольная доля; 2) степень диссоциации; 3) степень гидролиза; 4) константа диссоциации; 5) константа гидролиза | |||
| 47. | ПРИ РАЗБАВЛЕНИИ РАСТВОРА СТЕПЕНЬ ДИССОЦИАЦИИ 1) уменьшается; 2) не изменяется; 3) увеличивается | |||
| Гидролиз, ПР | ||||
| 48. | ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫПРИ 25°С 1) 10–7; 2) 10–10; 3) 10–12; 4) 10–14; 5) 10–16. | |||
| 49. | ОБЩАЯ КИСЛОТНОСТЬ – ЭТО КОНЦЕНТРАЦИЯ ИОНОВ Н+ 1) свободных в растворе; 2) связанных в недиссоциируемых молекулах; 3) свободных в растворе и связанных в недиссоциируемых молекулах | |||
| 50. | ПОТЕНЦИАЛЬНАЯ КИСЛОТНОСТЬ – ЭТО КОНЦЕНТРАЦИЯ ИОНОВ Н+ 4) свободных в растворе; 5) связанных в недиссоциируемых молекулах; 6) свободных в растворе и связанных в недиссоциируемых молекулах | |||
| 51. | АКТИВНАЯ КИСЛОТНОСТЬ – ЭТО КОНЦЕНТРАЦИЯ ИОНОВ Н+ 1) свободных в растворе; 2) связанных в недиссоциируемых молекулах; 3) свободных в растворе и связанных в недиссоциируемых молекулах | |||
| 52. | рН РАСТВОРА - ЭТО 1) натуральный логарифм активной концентрации ионов водорода; 2) десятичный логарифм активной концентрации ионов водорода; 3) отрицательный натуральный логарифм активной концентрации ионов водорода; 4) отрицательный десятичный логарифм активной концентрации ионов водорода; 5) отрицательный десятичный логарифм общей кислотности. | |||
| 53. | рН = 7 В РАСТВОРЕ 1) NaNO3; 2) CaSO4; 3) Sr(NO3)3; 4) K2CO3; 5) Na2SO3 | |||
| 54. | рН > 7 В РАСТВОРАХ СОЛЕЙ 1) Na NO3; 2) Ca(NO3)2; 3) K2SiO3; 4) Na2SO4; 5) K2SO4 | |||
| 55. | КОНСТАНТА ГИДРОЛИЗА БУРЫ(Na2B4O7) РАССЧИТЫВАЕТСЯ ПО ФОРМУЛЕ 1) К=Кводы / Ккисл; 2) К=Кводы / Ккисл *Косн; 3) К=Кводы / Косн | |||
| 56. | КОНСТАНТА ГИДРОЛИЗА АЦЕТАТА АММОНИЯ РАССЧИТЫВАЕТСЯ ПО ФОРМУЛЕ 1) К=Кводы / Ккисл; 2) К=Кводы / Ккисл *Косн; 3) К=Кводы / Косн | |||
| 57. | СОЛЬ, ГИДРОЛИЗУЮЩАЯСЯ И ПО КАТИОНУ, И ПО АНИОНУ 1) Al2S3; 2) KCl; 3) Na2CO3; 4) K2 SiO3; 5) NH4Cl | |||
| 58. | СТЕПЕНЬ ГИДРОЛИЗА AlCl3 ПРИ ПОДКИСЛЕНИИ 1) уменьшается; 2) увеличивается; 3) не изменяется; 4) сначала увеличивается, затем уменьшается; 5) сначала уменьшается, затем увеличивается | |||
| 59. | КИСЛОТА ЛЬЮИСА (АКЦЕПТОР ЭЛЕКТРОНОВ): 1. Cl–; 2. AlCl3; 3. I–-; 4. NH3; 5. Br– | |||
| 60. | СТЕПЕНЬ ГИДРОЛИЗА С УВЕЛИЧЕНИЕМ ТЕМПЕРАТУРЫ: 1) уменьшается, т.к. гидролиз – эндотермический процесс; 2) увеличивается, т.к. гидролиз – эндотермический процесс; 3) уменьшается, т.к. гидролиз – экзотермический процесс; 4) увеличивается, т.к. гидролиз – экзотермический процесс | |||
| 61. | ПРИ ГИДРОЛИЗЕ МОЛЕКУЛЫВЫСТУПАЮТ СОГЛАСНО ПРОТОЛИТИЧЕСКОЙ ТЕОРИИ 1) как кислоты; 2) как основания; 3) как кислоты или как основания | |||
| 62. | СТЕПЕНЬ ГИДРОЛИЗА ПРИ УМЕНЬШЕНИИ КОНЦЕНТРАЦИИ СОЛИ 1) уменьшается; 2) увеличивается; 3) не изменяется | |||
| 63. | ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ СОЗДАЕТСЯ ПРИ СОПРИКОСНОВЕНИИ ТВЕРДОЙ ФАЗЫС РАСТВОРОМ 1) ненасыщенным; 2) насыщенным; 3) пересыщенным; 4) разбавленным; 5) концентрированным | |||
| 64. | РАСТВОР ПЕРЕСЫЩЕН, ЕСЛИ 1. ИП>ПР; 2. ИП=ПР; 3. ИП<ПР; 4. ИП=2ПР; 5. 2ИП=ПР | |||
| 65. | РАСТВОР НАСЫЩЕН, ЕСЛИ 1. ИП>ПР; 2. ИП=ПР; 3. ИП<ПР; 4. ИП=2ПР; 5. 2ИП=ПР | |||
| 66. | ПР = S2 ДЛЯ ВЕЩЕСТВА 1. AgCl; 2. Ag2SО4; 3. Ag2CrO4; 4. Ag2S; 5. AgNO3 | |||
| 67. | С УВЕЛИЧЕНИЕМ ТЕМПЕРАТУРЫПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ(ПР) 1. увеличивается; 2. уменьшается; 3. не изменяется; 4. увеличивается в 10 раз; 5. уменьшается в 10 раз | |||
| 68. | ИЗ ПЕРЕЧИСЛЕННЫХ РАСТВОРОВ ПЕРВОЙ ВЫПАДАЕТ СОЛЬ 1. PbSO4 (ПР = 1,6 * 10-8); 2. SrSO4 (ПР = 3,2 * 10-7); 3. CaSO4 (ПР = 1,3 * 10-4); 4. BaSO4 (ПР = 1,1 * 10-10) | |||
| 69. | ПРИ РЕНТГЕНОСКОПИИ ЖЕЛУДКА ИСПОЛЬЗУЮТ СУСПЕНЗИЮ 1) CaSO4; 2) SrSO4; 3) BaSO4; 4) MgSO4; 5) CaSO4 | |||
| СПОСОБНОСТЬ СХОДНЫХ ПО СВОЙСТВАМ ВЕЩЕСТВ ОБРАЗОВЫВАТЬ СМЕШАННЫЕ КРИСТАЛЛЫ- ЭТО 1) гомеостаз; 2) седиментация; 3) изоморфизм; 4) коагуляция | ||||
| 71. | РАДИОАКТИВНЫЙ Sr90 ОПАСЕН, ТАК КАК ЗАМЕЩАЕТ В КОСТНОЙ ТКАНИ АТОМЫ 1) Ca; 2) P; 3) O; 4) H | |||
| 72. | РАСТВОРЫ, рН КОТОРЫХ СОХРАНЯЕТСЯ ПРИМЕРНО ПОСТОЯННЫМ ПРИ РАЗБАВЛЕНИИ И ДОБАВЛЕНИИ НЕБОЛЬШИХ КОЛИЧЕСТВ КИСЛОТ ИЛИ ОСНОВАНИЙ 1) сопряженные; 2) буферные; 3) разбавленные; 4) концентрированные; 5) нейтральные | |||
| 73. | ЗНАЧЕНИЕ рН БУФЕРНЫХ РАСТВОРОВ ПРИ РАЗБАВЛЕНИИ 1) не изменяется; 2) увеличивается на 1; 3) уменьшается на 1; 4) увеличивается на 2; 5) уменьшается на 2 | |||
| 74. | МАКСИМАЛЬНУЮ БУФЕРНУЮ ЕМКОСТЬ СИСТЕМЫИМЕЮТ ПРИ 1) рН=рК; 2) рН=рОН; 3) рН>рК; 4) рН<рК; 5) эти параметры не связаны между собой | |||
| 75. | МАКСИМАЛЬНОЙ БУФЕРНОЙ ЕМКОСТЬЮ ПРИ ФИЗИОЛОГИЧЕСКОМ ЗНАЧЕНИИ рН ОБЛАДАЕТ ПАРА
H3PO4|H2P  , pK=2,1;
H2PO4|HP , pK=2,1;
H2PO4|HP  , pK=6,8;
HPO42-|P , pK=6,8;
HPO42-|P 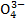 , pK=12,3;
HCOO-|HCOOH, pK=3,74;
CH3COO-|CH3COOH, pK=4,74; , pK=12,3;
HCOO-|HCOOH, pK=3,74;
CH3COO-|CH3COOH, pK=4,74;
| |||
| 76. | БУФЕРНЫЕ СИСТЕМЫПОДДЕРЖИВАЮТ В ОРГАНИЗМЕ РАВНОВЕСИЯ 1) кислотно-основные; 2) окислительно-восстановительные; 3) гетерогенные; 4) лигандообменные; 5) кислотно-солевые | |||
| 77. | В ОРГАНИЗМЕ ИМЕЕТ МЕСТО РАВНОВЕСИЕ H+ + HCO-3 ↔ H2CO3 ↔ H2O + CO2 (плазма) ↔ CO2 (легкие). ГИПОВЕНТИЛЯЦИЯ ЛЕГКИХ ПРИВОДИТ 1. к увеличению щелочного резерва крови; 2. к уменьшению рОН мочи; 3. к уменьшению щелочного резерва крови; 4. к увеличению рН мочи; 5. рН мочи не изменяется | |||
| 78. | БРОНХИТ ПРИВОДИТ К УВЕЛИЧЕНИЮ СОДЕРЖАНИЯ CO2 В ЛЁГКИХ, НАБЛЮДАЕТСЯ 1) дыхательный ацидоз; 2) уменьшение рОН; 3) рН не изменяется; 4) дыхательный алкалоз 5) метаболический алкалоз | |||
| 79. | ФОСФАТНАЯ БУФЕРНАЯ СИСТЕМА ДЕЙСТВУЕТ 1) в плазме крови; 2) в лейкоцитах; 3) в моче; 4) в селезенке | |||
| 80. | Гемоглобиновая буферная система действует 1. в плазме крови; 2. в эритроцитах; 3. в лейкоцитах; 4. в печени; 5. в кишечном тракте | |||
| 81. | 75% БУФЕРНОЙ ЕМКОСТИ КРОВИ ОБЕСПЕЧИВАЕТСЯ БУФЕРОМ 1) бикарбонатным; 2) ацетатным; 3) фосфатным; 4) белковым; 5) гемоглобиновым | |||
| Химическая термодинамика | ||||
| 82. | ФОРМУЛА ДЛЯ РАСЧЕТА РН БУФЕРНЫХ СИСТЕМ I ТИПА
1) рН=–lg [H+];
2) pH=pK+lg 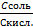 ;
3) pH=14–pK–lg ;
3) pH=14–pK–lg 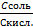 ;
4) рН=–ln [H+];
5) pH=pK–lg ;
4) рН=–ln [H+];
5) pH=pK–lg 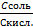
| |||
| 83. | КОЛИЧЕСТВО КИСЛОТЫИЛИ ЩЕЛОЧИ, ДОБАВЛЕНИЕ КОТОРОГО К 1 Л БУФЕРНОГО РАСТВОРА ИЗМЕНЯЕТ рН НА ЕДИНИЦУ – ЭТО 1) молярность; 2) моляльность; 3) буферная емкость; 4) молярная концентрация эквивалента | |||
| 84. | БУФЕРНАЯ СИСТЕМА: 1) NH3·H2O и NH4Cl; 2) NH4Cl и HCl; 3) NH3·H2O и NaOH; 4) C6H5COOH и HCl; 5) HCOOH и HCl | |||
| 85. | рН БУФЕРНОЙ СИСТЕМЫПРИ РАЗБАВЛЕНИИ В 10 РАЗ 1) увеличится в 10 раз; 2) увеличится на единицу; 3) уменьшится на единицу; 4) практически не изменится; 5) уменьшится в 10 раз | |||
| 86. | УРАВНЕНИЕ ГЕНДЕРСОНА-ГАССЕЛЬБАХА ДЛЯ БУФЕРНЫХ СИСТЕМ 2 ТИПА
1) pH=pK+lg 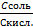 ;
2) pH=14–pK–lg ;
2) pH=14–pK–lg 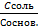 ;
3) рН=рК±1;
4) pH=pK–lg ;
3) рН=рК±1;
4) pH=pK–lg 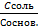 5) pH=14–pK+lg
5) pH=14–pK+lg 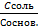 ; ;
| |||
| 87. | МАКСИМАЛЬНАЯ БУФЕРНАЯ ЕМКОСТЬ НАБЛЮДАЕТСЯ ПРИ СООТНОШЕНИИ Ссопр.осн.: Скисл. 1) 1:1; 2) 1:10; 3) 10:1; 4) 5:10; 5) 1:2 | |||
| 88. | НАИБОЛЕЕ БЫСТРОДЕЙСТВУЮЩЕЙ В ОРГАНИЗМЕ ЯВЛЯЕТСЯ БУФЕРНАЯ СИСТЕМА 1) фосфатная; 2) гидрокарбонатная; 3) гидрофосфатная; 4) гемоглобиновая; 5) белковая | |||
| 89. | ФОРМУЛА ДЛЯ РАСЧЕТА БУФЕРНОЙ ЕМКОСТИ ПО КИСЛОТЕ
1) Вк=  ;
2) Вк= ;
2) Вк= 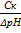 ;
3) Вк= ;
3) Вк=  ;
4) Вк= ;
4) Вк= 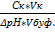 ;
5) Вк= ;
5) Вк= 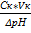
| |||
| 90. | ПРИ ЗАБОЛЕВАНИЯХ, СВЯЗАННЫХ С НАРУШЕНИЕМ ДЫХАТЕЛЬНОЙ ФУНКЦИИ ЛЕГКИХ, ПРИВОДЯЩИМ К УВЕЛИЧЕНИЮ СОДЕРЖАНИЯ СО2 В ЛЕГКИХ, НАБЛЮДАЕТСЯ 1) дыхательный ацидоз; 2) рН не изменяется; 3) дыхательный алкалоз; 4) метаболический алкалоз; 5) метаболический ацидоз. | |||
| 91. | У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ ЗА СЧЕТ НАКОПЛЕНИЯ В ОРГАНИЗМЕ β-ГИДРОКСИМАСЛЯНОЙ КИСЛОТЫРАЗВИВАЕТСЯ 1) метаболический алкалоз; 2) респираторный алкалоз; 3) метаболический ацидоз; 4) респираторный ацидоз; 5) рН не изменяется. | |||
| Химическая термодинамика | ||||
| 92. | СИСТЕМА, КОТОРАЯ НЕ ОБМЕНИВАЕТСЯ НИ ВЕЩЕСТВОМ, НИ ЭНЕРГИЕЙ С ОКРУЖАЮЩЕЙ СРЕДОЙ 1) закрытая; 2) открытая; 3) изолированная; 4) равновесная; 5) стационарная | |||
| 93. | СИСТЕМА, КОТОРАЯ НЕ ОБМЕНИВАЕТСЯ ВЕЩЕСТВОМ, НО ОБМЕНИВАЕТСЯ ЭНЕРГИЕЙ С ОКРУЖАЮЩЕЙ СРЕДОЙ 1) закрытая; 2) открытая; 3) изолированная; 4) равновесная; 5) стационарная | |||
| 94. | СИСТЕМА, ОБМЕНИВАЮЩАЯСЯ И ВЕЩЕСТВОМ И ЭНЕРГИЕЙ 1) закрытая; 2) открытая; 3) изолированная; 4) равновесная; 5) стационарная | |||
| 95. | РЕАКЦИЯ, ТЕПЛОВОЙ ЭФФЕКТ КОТОРОЙ РАВЕН ТЕПЛОТЕ ОБРАЗОВАНИЯ ГЛЮКОЗЫ 1) 6С + 6H2 + 3O2 = C6H12O6; 2) 6СO2 + 6H2O = C6H12O6 + 6O2; 3) 6С + 6H2O = C6H12O6; 4) С12 H22O11 + H2O = C6H12O6 + C6H12O6 | |||
| 96. | ПРИ РАСТВОРЕНИИ ТВЕРДЫХ ВЕЩЕСТВ ЭНТРОПИЯ 1) убывает; 2) возрастает; 3) не изменяется | |||
| 97. | ЭНТРОПИЯ ПРИ КАРИЕСЕ 1) убывает; 2) возрастает; 3) не изменяется | |||
| 98. | КРИТЕРИЙ САМОПРОИЗВОЛЬНО ПРОТЕКАЮЩИХ ПРОЦЕССОВ 1) энтальпия 2) энергия Гиббса 3) энтропия 4) внутренняя энергия | |||
| 99. | НАПРАВЛЕНИЯ ПРОТЕКАНИЯ РЕАКЦИИ H3PO4 + АДЕНОЗИН = АМФ + H2O, ∆ G0 = 14 кДж/моль 1) прямое; 2) обратное; 3) реакция находится в состоянии равновесия; 4) любое; 5) требуются дополнительные условия | |||
| 100. | РЕАКЦИЯ ЭКЗОТЕРМИЧЕСКАЯ, ЕСЛИ 1) DН>0; 2) DН=0; 3) DН<0; 4) DG>0; 5) DG<0 | |||
| ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ РАВНА 0: 1) O2; 2) H2O; 3) NaCl; 4) CH4; 5) HCl | ||||
| Энтропия увеличивается в реакции: 1) 2H2+O2=2H2O; 2) 4HCl+O2=2Cl2+2H2O; 3) CaO+CO2=CaCO3; 4) NH4NO2=N2+2H2O; 5) BaO+SO3=BaSO4 | ||||
| ТЕПЛОВОЙ ЭФФЕКТ ПРОЦЕССА НЕ ЗАВИСИТ ОТ ПУТИ ПРОЦЕССА, А ОПРЕДЕЛЯЕТСЯ НАЧАЛЬНЫМ И КОНЕЧНЫМ СОСТОЯНИЕМ СИСТЕМЫ– ЭТО ЗАКОН 1) Клайперона; 2) Гесса; 3) Фика; 4) Дальтона | ||||
| Экзергонический процесс, если 1) DG>0; 2) DG<0; 3) DG=0; 4) DH>0; 5) DH<0 | ||||
| ЗАКОН, ЛЕЖАЩИЙ В ОСНОВЕ РАСЧЕТОВ КАЛОРИЙНОСТИ ПРОДУКТОВ ПИТАНИЯ: 1) Вант-Гоффа; 2) Гесса; 3) Сеченова; 4) Рауля; 5) Клайперона | ||||
| 106. | ДЛЯ ОБРАТИМЫХ ПРОЦЕССОВ: 1) DG<0; 2) DG>0; 3) DG=0; | |||
| 107. | ЭНДЭРГОНИЧЕСКИЕ РЕАКЦИИ В ОРГАНИЗМЕ ТРЕБУЮТ ПОДВОДА ЭНЕРГИИ, ТАК КАК 1) DG>0; 2) DG<0; 3) DG=0; 4) DG£0 | |||
| 108. | ПРИ ГИДРОЛИЗЕ ЛЮБОГО ПЕПТИДА DH<0, DS>0, ПРОТЕКАЕТ ЛИ ПРОЦЕСС САМОПРОИЗВОЛЬНО? 1) да, т.к. DG>0; 2) нет, т.к. DG>0; 3) да, т.к. DG<0; 4) нет, т.к. DG<0 | |||
| 109. | ДЛЯ ПРОЦЕССА ФОТОСИНТЕЗА DH>0, DS<0, ПРОТЕКАЕТ ЛИ ПРОЦЕСС САМОПРОИЗВОЛЬНО? 1) процесс неосуществим при любых температурах; 2) процесс осуществим при любых температурах; 3) процесс осуществим при высоких температурах; 4) процесс осуществим при низких температурах | |||
| 110. | ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ВЕЩЕСТВА ЗА ЕДИНИЦУ ВРЕМЕНИ ЭТО 1) константа скорости; 2) энергия активации; 3) скорость реакции; 4) константа равновесия | |||
| РАЗМЕРНОСТЬ СКОРОСТИ ХИМИЧЕСКИХ РЕАКЦИЙ 1. моль/л*с; 2. км/час; 3. кДж/моль; 4. с-1 | ||||
| 112. | ЧИСЛО МОЛЕКУЛ, УЧАСТВУЮЩИХ В ЭЛЕМЕНТАРНОМ АКТЕ ХИМИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ 1) порядок реакции; 2) скорость реакции; 3) молекулярность реакции; 4) стехиометрия | |||
| 113. | ВРЕМЯ, ЗА КОТОРОЕ ПРОРЕАГИРУЕТ ПОЛОВИНА ВЕЩЕСТВА – ЭТО 1) ПЕРИОД ПОЛУПРЕВРАЩЕНИЯ; 2) ПОРЯДОК РЕАКЦИИ; 3) КОНСТАНТА СКОРОСТИ; 4) КОНСТАНТА РАВНОВЕСИЯ | |||
| 114. | МОЛЕКУЛЯРНОСТЬ ЭЛЕМЕНТАРНОЙ РЕАКЦИИ 2NO + O2 = 2NO2 1) 0; 2) 1; 3) 2; 4) 3 | |||
| 115. | ЗАКОН ДЕЙСТВУЮЩИХ МАСС УСТАНАВЛИВАЕТ ЗАВИСИМОСТЬ МЕЖДУ СКОРОСТЬЮ ХИМИЧЕСКОЙ РЕАКЦИИ И 1) температурой; 2) концентрацией реагирующих веществ; 3) массой реагирующих веществ; 4) количеством реагирующих веществ; 5) количеством продуктов реакции | |||
| 116. | СУММА ПОКАЗАТЕЛЕЙ СТЕПЕНЕЙ ПРИ КОНЦЕНТРАЦИЯХ, ВХОДЯЩИХ В КИНЕТИЧЕСКОЕ УРАВНЕНИЕ НАЗЫВАЕТСЯ 1) общим кинетическим порядком реакции; 2) молекулятностью реакции; 3) порядком реакции по веществу; 4) стехиометрическими коэффициентами; 5) константой скорости реакции | |||
| 117. | БИОХИМИЧЕСКИЕ РЕАКЦИИ, ПРОТЕКАЮЩИЕ В ОРГАНИЗМЕ, ЯВЛЯЮТСЯ РЕАКЦИЯМИ 1) 1 порядка; 2) 0 порядка; 3) 1 порядка, переходящие в реакции 0 порядка; 4) 2 порядка, переходящие в реакции 1 порядка; 5) обратимыми | |||
| 118. | ЛИМИТИРУЮЩАЯ СТАДИЯ СЛОЖНОЙ ХИМИЧЕСКОЙ РЕАКЦИИ ЯВЛЯЕТСЯ 1) самой быстрой; 2) самой медленной; 3) самой сложной; 4) стадией, имеющей высокую энергию активации; 5) стадией, имеющей первый порядок | |||
| 119. | ВЫХОД МОЧЕВИНЫПРИ УВЕЛИЧЕНИИ ДАВЛЕНИЯ CO2 + 2NH3 ↔ H2O + CO(NH2)2 1) увеличится; 2) уменьшится; 3) не изменится | |||
| 120. | ∆G0 = - RTlnK это уравнение 1) изотермы; 2) изобары; 3) изохоры химической реакции | |||
| Константа равновесия при 298 К равна 1, тогда ∆G 1) ∆G < 0 2) ∆G = 0 3) ∆G > 0 | ||||
| 122. | СООТНОШЕНИЕ, ПРИ КОТОРОМ СИСТЕМА НАХОДИТСЯ В СОСТОЯНИИ РАВНОВЕСИЯ 1) DH=–TDS; 2) DH>–TDS; 3) DH<–TDS; 4) DH=TDS; 5) DH=DS | |||
| 123. | ВЫХОД ПРОДУКТА РЕАКЦИИ 2SO2+O2«2SO3 УМЕНЬШИТ 1) увеличение концентрации О2; 2) увеличение концентрации SO2; 3) увеличение давления; 4) уменьшение температуры | |||
| 124. | КОНСТАНТА СКОРОСТИ РЕАКЦИИ ЗАВИСИТ ОТ: 1) времени реакции, температуры, катализатора; 2) природы веществ, температуры; концентрации; 3) природы веществ, температуры, катализатора; 4) природы веществ, температуры. | |||
| 125. | КОНСТАНТА РАВНОВЕСИЯ ИЗМЕНИТСЯ ПРИ: 1) введении катализатора; 2) изменении концентраций; 3) повышении температуры; 4) понижении температуры. | |||
| 126. | ПРИ ИЗМЕНЕНИИ КОЛИЧЕСТВА ВЕЩЕСТВА А СКОРОСТЬ НЕ ИЗМЕНИТСЯ ДЛЯ РЕАКЦИИ: 1) А(г)+В(г)® 2) 2А(г)+В2(г)® 3) 2А(г)+2В(г)® 4) 3А(г)+В2(г)® | |||
| 127. | СООТНОШЕНИЕ МЕЖДУ РАВНОВЕСНЫМИ КОНЦЕНТРАЦИЯМИ ОПРЕДЕЛЯЕТ ЗАКОН: 1) Вант-Гоффа; 2) Рауля; 3) действующих масс; 4) Гесса | |||
| Реакции комплекообразования | ||||
| 128. | СОЕДИНЕНИЕ ПОСТОЯННОГО СОСТАВА, ОБРАЗОВАННЫЕ С УЧАСТИЕМ ДОНОРНО – АКЦЕПТОРНЫХ СВЯЗЕЙ 1) комплексные; 2) двойные; 3) смешанные; 4) бинарные; 5) кластерные | |||
| 129. | ЧИСЛО ИОНОВ ИЛИ МОЛЕКУЛ, РАСПОЛОЖЕННЫХ ВОКРУГ ЦЕНТРАЛЬНОГО АТОМА 1) дентантность; 2) координационное число; 3) заряд ядра; 4) заряд катиона; 5) заряд аниона | |||
| 130. | КОМПЛЕКСООБРАЗОВАТЕЛЬ В ГЕМОГЛОБИНЕ 1) Cu0; 2) Fe3+; 3) Fe0; 4) Fe2+; 5) Mg2+ | |||
| 131. | СВЯЗЬ МЕЖДУ КОМПЛЕКСООБРАЗОВАТЕЛЕМ И ЛИГАНДАМИ 1) ковалентная по донорно – акцепторному механизму; 2) ковалентная по обменному механизму; 3) ионная; 4) водородная; 5) атомная | |||
| 132. | ДЕНТАНТНОСТЬ – ЭТО 1) число связей между комплексообразователем и лигандами; 2) число электронодонорных атомов в лиганде; 3) заряд коплексообразователя; 4) заряд комплексного иона; 5) число лигандов | |||
| 133. | В ХЕЛАТНЫЕ СОЕДИНЕНИЯ ВХОДЯТ ЛИГАНДЫ 1) монодентантные; 2) полидентантные; 3) нейтральные; 4) положительно заряженные | |||
| 134. | НАЗВАНИЕ Na [Co(NH3)2 (N02)4] 1) диамминкобальтат натрия; 2) тетранетрокобальтат натрия; 3) диамминтетранитрокобальтат (II) натрия; 4) диамминтетранитрокобальтат (III) натрия; 5) диамминтетранитрокобальтат натрия | |||
| 135. | ЧИСЛО МОЛЬ ИОНОВ, ОБРАЗУЮЩИХСЯ ПРИ ПЕРВИЧНОЙ ДИССОЦИАЦИИ ОДНОГО МОЛЯ ГЕКСАЦИАНОФЕРРАТА (II) КАЛИЯ 1) 1; 2) 2; 3) 3; 4) 4; 5) 5 | |||
| 136. | СТЕПЕНЬ ОКИСЛЕНИЯ КОМПЛЕКСООБРАЗОВАТЕЛЯ В СОЕДИНЕНИИ [Pt(NH3)5B]r(N03)3 1) +1; 2) +2; 3) +3; 4) +4; 5) +6 | |||
| 137. | КООРДИНАЦИОННОЕ ЧИСЛО КОМПЛЕКСООБРАЗОВАТЕЛЯ В КОМПЛЕКСЕ Na3[Co(СN)6] РАВНО 1) 3; 2) 2; 3) 6; 4) 9; 5) 4 | |||
| 138. | КОМПЛЕКСООБРАЗОВАТЕЛЬ В ХЛОРОФИЛЛЕ: 1) Сu0; 2) Cu2+; 3) Fe3+ ; 4) Fe2+ | |||
| 139. | ЛИГАНДЫ-ЭТО 1) молекулы, доноры электронных пар; 2) ионы, акцепторы электронных пар; 3) молекулы и ионы-акцепторы электронных пар; 4) молекулы и ионы-доноры электронных пар | |||
| 140. | КООРДИНАЦИОННОЕ ЧИСЛО ЦЕНТРАЛЬНОГО АТОМА И ЕГО ЗАРЯД В СОЕДИНЕНИИ [Pt(NH3)4Cl2]Cl2 1) 6,+4; 2) 6,+2; 3) 4,+4; 4) 4,+2 5) 6, +2 | |||
| 141. | ЧЕМ МЕНЬШЕ Кн., ТЕМ КОМПЛЕКС БОЛЕЕ: 1) устойчивый; 2) устойчивость не определяется Кн, 3) неустойчивый; 4) растворимый. | |||
| 142. | ЗАРЯД ВНУТРЕННЕЙ СФЕРЫВ СОЕДИНЕНИИ К4[Fe(CN)6]: 1) +4; 2) –4; 3) –3; 4) –2. 5) +3 | |||
| 143. | КООРДИНАЦИОННОЕ ЧИСЛО ЦЕНТРАЛЬНОГО АТОМА И ЕГО ЗАРЯД В СОЕДИНЕНИИ [Co(NH3)3Cl3]: 1) 6,+3; 2) 4,+3; 3) 6,+2; 4) 4,+3; 5) 6; +2 | |||
| 144. | УСТОЙЧИВОСТЬ КОМПЛЕКСА С УВЕЛИЧЕНИЕМ ЧИСЛА ДОНОРНЫХ АТОМОВ В ПОЛИДЕНТАНТНОМ ЛИГАНДЕ: 1) увеличивается; 2) уменьшается; 3) не изменяется | |||
| 145. | СОЕДИНЕНИЕ, КОТОРОЕ НЕ ПОДВЕРГАЕТСЯ ПЕРВИЧНОЙ ДИССОЦИАЦИИ 1) K2[PtCl6]; 2) [Co(NH3)6]Cl3; 3) [Pt(NH3)2Cl2]; 4) [Ag(NH3)2]OH; 5) К3[Fe(CN)6]: | |||
| 146. | ЛУЧШИЙ КОМПЛЕКСООБРАЗОВАТЕЛЬ ИЗ: Na, Mg, Co,Al 1) Na; 2) Mg; 3) Co; 4) Al | |||
| 147. | СВЯЗЬ МЕЖДУ КОМПЛЕКСООБРАЗОВАТЕЛЕМ И ЛИГАНДАМИ: 1) ковалентная по донорно-акцепторному механизму 2) ковалентная по обменному механизму 3) ионная 4) водородная | |||
| 148. | Координационное число центрального атома и его заряд в соединении [Cr(NH3)2Cl2] 1) 4,+2; 2) 6,+3; 3) 2,+2; 4) 6,+2 5) 6, +4 | |||
| 149. | Степень окисления и тип гибридизации центрального атома в соединении [Ag(NH3)2]Cl: 1) +1,sp; 2) +1,sp2; 3) +2,sp; 4) 0,sp; 5) 0,sp2 | |||
| 150. | Наименьшая комплексообразующая способность у: 1) s-элементов; 2) p-элементов; 3) d-элементов; 4) f-элементов | |||
| 151. | Наиболее прочный ион: 1) Кн [Zn(OH)4 ]2- =1,99·10-18 ; 2) Кн [Zn(CN)4]2- =2,4 ·10-20; 3) Кн [Zn(NH3)4]2+ =8,3 ·10-12; 4) Кн [Zn(H2O)4]2+ =2,1 ·10-10 | |||
| 152. | Комплексообразователь в молекуле витамина В12 : 1) Fe+2; 2) Co+2; 3) Ni+2; 4) Mg+2 | |||
| 153. | Ряд, в котором способность к комплексообразованию увеличивается 1) f>d>p>s 2) d>f>p>s 3) s>p>d>f 4) p>s>d>f | |||
| Физико-химия поверхностных явлений | ||||
| 154. | ПОВЕРХНОСТНО – АКТИВНЫЕ ВЕЩЕСТВА ПО ОТНОШЕНИЮ К ВОДЕ 1) этанол; 2) хлорид натрия; 3) фруктоза; 4) сахароза; 5) глюкоза | |||
| 155. | ВЕЩЕСТВА, ПОНИЖАЮЩИЕ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ РАСТВОРИТЕЛЯ 1) Активаторы; 2) Поверхностно – неактивные; 3) Поверхностно – активные | |||
| 156. | ПОВЕРХНОСТНАЯ АКТИВНОСТЬ ПАВ С УВЕЛИЧЕНИЕМ УГЛЕВОДОРОДНОГО РАДИКАЛА 1) увеличивается; 2) уменьшается; 3) не изменяется | |||
| 157. | САМОПРОИЗВОЛЬНОЕ УВЕЛИЧЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРЕННОГО ВЕЩЕСТВА НА ГРАНИЦЕ РАЗДЕЛА ФАЗ ПО СРАВНЕНИЮ С ОБЪЕМНОЙ КОНЦЕНТРАЦИЕЙ 1) абсорбция; 2) адгезия; 3) адсорбция; 4) возгонка | |||
| 158. | ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ВОДЫПРИ ДОБАВЛЕНИИ СПИРТА C2H5OН 1) увеличится; 2) уменьшится; 3) не изменится | |||
| 159. | АДСОРБЕНТ, ПОГЛОЩАЮЩИЙ ИЗ РАСТВОРА КАТИОНЫ, ВЫДЕЛЯЯ ОДНОВРЕМЕННО В РАСТВОР ЭКВИВАЛЕНТНОЕ КОЛИЧЕСТВО КАТИОНОВ ДРУГОГО РОДА 1) анионит; 2) катионит; 3) мембрана | |||
| 160. | ВЕЩЕСТВО, НА ПОВЕРХНОСТИ КОТОРОГО ПРОИСХОДИТ АДСОРБЦИЯ, НАЗЫВАЕТСЯ 1) адсорбатом; 2) адсорбентом; 3) десорбцией | |||
| 161. | СИСТЕМЫ, СОСТОЯЩИЕ ИЗ ТВЕРДОЙ ДИСПЕРСНОЙ ФАЗЫИ ЖИДКОЙ ДИСПЕРСИОННОЙ СРЕДЫ 1) аэрозоли; 2) лиозоли; 3) криозоли; 4) пены; 5) суспензия | |||
| 162. | ДВИЖЕНИЯ ДИСПЕРСИОННОЙ СРЕДЫВ ПОСТОЯННОМ ЭЛЕКТРИЧЕСКОМ ПОЛЕ К ПРОТИВОПОЛОЖНО ЗАРЯЖЕННОМУ ЭЛЕКТРОДУ – ЭТО 1) электроосмос; 2) электрофорез; 3) потенциал течения | |||
| В КРОВИ ДИСПЕРСИОННОЙ СРЕДЫЯВЛЯЕТСЯ 1) вода; 2) эритроциты; 3) кислород; 4) СО2 | ||||
| 164. | ПОГЛОЩЕНИЕ ВЕЩЕСТВА ВСЕЙ МАССОЙ АДСОРБЕНТА: 1) адсорбция; 2) абсорбция; 3) сорбция; 4) десорбция | |||
| 165. | ПЕРМУТИТ (Na2O·Al2O3·SiO2·H2O), ИСПОЛЬЗУЕМЫЙ ДЛЯ УМЯГЧЕНИЯ ВОДЫОБМЕНИВАЕТ НА ИОНЫСа2+: 1) Na+; 2) Al3+ ; 3) Si4+ ; 4) различные ионы. | |||
| 166. | ЕДИНИЦЫИЗМЕРЕНИЯ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ: 1) н/м; Дж/м2; 2) н/м2; Дж/м; 3) Дж/моль·К; 4) Дж/м; Дж/м2 | |||
| 167. | ИЗ ИОНОВ: К+ , Ca2+ , Al3+ МИНИМАЛЬНОЙ АДСОРБЦИОННОЙ СПОСОБНОСТЬЮ ОБЛАДАЕТ: 1) К+ ; 2) Ca2+ ; 3) Al3+; 4) адсорбционная способность одинакова. | |||
| 168. | ИЗОТЕРМА АДСОРБЦИИ ФРЕЙНДЛИХА: 1) Г= Г∞ С / I+αС; 2) Г=κ ·С; 3) х/ m = κ·С1|n ; 4) Г=ΔС·V/ m | |||
| 169. | ИЗ ИОНОВ ОДИНАКОВОГО ЗАРЯДА МИНИМАЛЬНУЮ АДСОРБЦИОННУЮ СПОСОБНОСТЬ ПРОЯВЛЯЮТ ИОНЫ: 1) наибольшего радиуса; 2) величина радиуса не имеет значения; 3) наименьшего радиуса. | |||
| 170. | ПОВЕРХНОСТОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ С ПОВЫШЕНИЕМ ТЕМПЕРАТУРЫ 1) увеличивается; 2) уменьшается; 3) не изменяется; 4) изменяется неоднозначно. | |||
| 171. | Изотерма адсорбции Лэнгмюра: 1) Г= Г∞ С / I+αС; 2) Г=κ ·С; 3) х/ m = κ·С1|n ; 4) Г=ΔС·V/ m. | |||
| 172. | Активированный уголь- гидрофобный сорбент и лучше адсорбирует: 1) полярные вещества из неполярных растворителей; 2) неполярные вещества из полярных растворителей; 3) полярные вещества из полярных растворителей; 4) неполярные вещества из неполярных растворителей. | |||
| 173. | К ПНВ относятся: 1) сахароза; 2) фосфолипиды; 3) желчные кислоты; 4) белки. | |||
| 174. | ПОВЕРХНОСТНАЯ АКТИВНОСТЬ БУТАНОЛА БОЛЬШЕ ПОВЕРХНОСТНОЙ АКТИВНОСТИ ЭТАНОЛА В 1) 4 раза; 2) 6 раз; 3) 9 раз; 4) 12 раз; 5) 15 раз | |||
| Коллоидные растворы | ||||
| 175. | МЕТОД ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ И РАСТВОРОВ ВМС С ПОМОЩЬЮ МЕМБРАН, ПО ПРИНЦИПУ КОТОРОГО РАБОТАЕТ «ИСКУССТВЕННАЯ ПОЧКА» 1) хроматография; 2) фильтрация; 3) диализ | |||
| 176. | ОПТИЧЕСКОЕ СВОЙСТВО ВСЕХ КОЛЛОИДНЫХ РАСТВОРОВ 1) отражение света; 2) рассеяние света; 3) поглощение света | |||
| 177. | ДВИЖЕНИЯ ЧАСТИЦ ДИСПЕРСНОЙ ФАЗЫВ ПОСТОЯННОМ ЭЛЕКТРИЧЕСКОМ ПОЛЕ К ПРОТИВОПОЛОЖНО ЗАРЯЖЕННОМУ ЭЛЕКТРОДУ 1) диализ; 2) электроосмос; 3) электрофорез | |||
| 178. | УСТОЙЧИВОСТЬ, ХАРАКТЕРИЗУЮЩАЯ СПОСОБНОСТЬ СИСТЕМЫСОХРАНЯТЬ ПОСТОЯННЫМ РАЗМЕР ЧАСТИЦ 1) кинетическая; 2) агрегативная; 3) оптическая | |||
| 179. | УКРУПНЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ ЗА СЧЕТ ИХ СЛИПАНИЯ СЕДИМЕНТАЦИЕЙ 1) коагуляция; 2) опалесценция; 3) солюбилизация | |||
| 180. | ЗНАЧЕНИЯ рН РАСТВОРА БЕЛКА, ПРИ КОТОРОМ МОЛЕКУЛА СТАНОВИТСЯ ЭЛЕКТРОНЕЙТРАЛЬНОЙ 1) золотое число; 2) изоэлектическая точка; 3) критическое | |||
| 181. | ПРОНИКНОВЕНИЕ РАСТВОРИТЕЛЯ В ПОЛИМЕРНОЕ ВЕЩЕСТВО, ПРИВОДЯЩЕЕ К УВЕЛИЧЕНИЮ МАССЫИ ОБЪЕМА ОБРАЗЦА 1) набухание; 2) седиментация; 3) высаливание | |||
| 182. | МАКСИМАЛЬНАЯ КОАГУЛИРУЮЩАЯ СПОСОБНОСТЬ У ИОНА 1) Сl- 2) SO42- 3) PO43- 4) [Fe(СN)6]4- | |||
| 183. | КОЛЛАРГОЛ – ЭТО 70% ЗОЛЬ СЕРЕБРА, СТАБИЛИЗИРОВАННЫЙ 1) белками; 2) порошком угля; 3) силикагелем | |||
| 184. | МЫЛА, СИНТЕТИЧЕСКИЕ МОЮЩИЕ СРЕДСТВА, ФОСФОЛИПИДЫ 1) пептизаторы; 2) электролиты; 3) коллоидные ПАВ | |||
| 185. | КОАГУЛЯЦИЯ, НЕВИДИМАЯ НЕВООРУЖЕННЫМ ВЗГЛЯДОМ 1) скрытая; 2) явная; 3) медленная; 4) быстрая | |||
| 186. | РАЗМЕР КОЛЛОИДНЫХ ЧАСТИЦ: 1) менее 10-9м; 2) 10-9 – 10-7м; 3) более 10-7м; 4) 10-5 – 10-7м. | |||
| 187. | ДИСПЕРСНАЯ СИСТЕМА, СОСТОЯЩАЯ ИЗ ТВЕРДОЙ ДИСПЕРСНОЙ ФАЗЫИ ЖИДКОЙ ДИСПЕРСНОЙ СРЕДЫ: 1) эмульсия; 2) пена; 3) аэрозоль; 4) суспензия | |||
| 188. | РАССЕИВАНИЕ СВЕТА В КОЛЛОИДНЫХ СИСТЕМАХ И НАБЛЮДАЮЩЕЕСЯ ПРИ ЭТОМ ИЗМЕНЕНИЕ ОКРАСКИ: 1) эффект Тиндаля; 2) диффузия; 3) седиментация; 4) опалесценция. | |||
| 189. | ДИСПЕРСНАЯ СИСТЕМА, СОСТОЯЩАЯ ИЗ ЖИДКОЙ ДИСПЕРСНОЙ ФАЗЫИ ЖИДКОЙ ДИСПЕРСИОННОЙ СРЕДЫ: 1) эмульсия; 2) пена; 3) аэрозоль; 4) суспензия. | |||
| 190. | КОАГУЛИРУЮЩИЕ ДЕЙСТВИЕ ЭЛЕКТРОЛИТА ОПРЕДЕЛЯЕТСЯ ПРАВИЛОМ:
1) Панета – Фаянса;
2) Шульце – Гарди;
3) Ребиндера;
4) Шилова
Поиск по сайту©2015-2024 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2017-11-15 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд |