Строение ферментов. Каталитический и регуляторный центры. Взаимодействие ферментов с лигандами. Механизм действия ферментов. Формирование фермент-субстратного комплекса. Гипотеза «ключ-замок» и гипотеза индуцированного соответствия.
Ферменты – катализаторы белковой природы
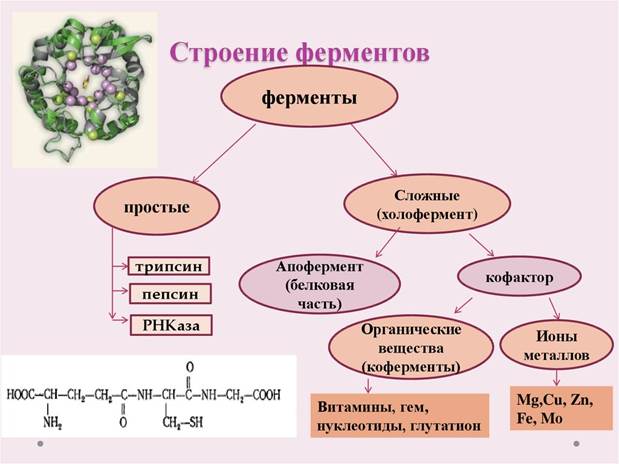
Простые-протеины, сложные-протеиды
Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ.
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
В свою очередь в активном центре выделяют два участка:
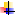 якорный(контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
якорный(контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
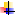 каталитический – непосредственно отвечает за осуществление реакции.
каталитический – непосредственно отвечает за осуществление реакции.
Аллостерический центр (allos– чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение пространственной конфигурации белка-фермента (активного центра) и, как следствие, скорости ферментативной реакции.
Аллостерические центры найдены не у всех ферментов. Они есть у ферментов, работа которых изменяется под действием гормонов, медиаторов и других биологически активных веществ.

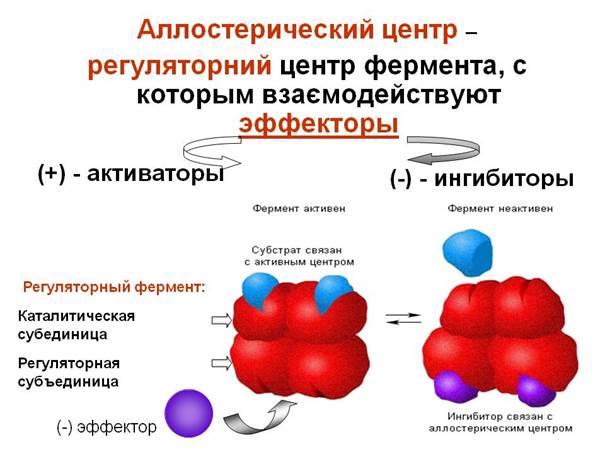
Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. В белках, состоящих из нескольких субъединиц, конформационные изменения в одной субъединице часто влекут за собой изменения в другой субъединице.
Взаимодействие лигандов с ферментами может регулироваться, что обычно достигается посредством специфических взаимодействий с еще одним или несколькими лигандами. Эти дополнительные лиганды могут вызывать конформационные изменения в молекуле белка, влияющие на связывание первого лиганда.
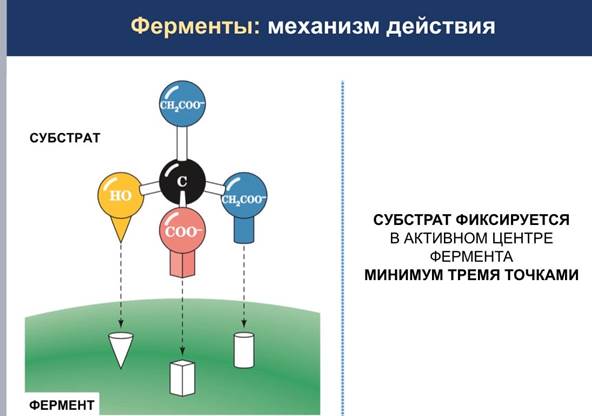
Процесс ферментативного катализа условно можно разделить на этапы:
На этапе I происходит сближение и ориентация субстрата в области активного центра фермента.
На этапе II в результате индуцированного соответствия [изменение конформации субстрата (S) и активного центра фермента] образуется фермент-субстратный комплекс (ES).
На этапе III происходит дестабилизация связей в субстрате и образование нестабильного комплекса фермент-продукт (ЕР).
На этапе IV происходит распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра и освобождением фермента.
Итак, в ходе катализа субстрат, связанный с активным центром фермента в фермент-субстратный (ES) комплекс, претерпевает химическое превращение в продукт, который затем высвобождается.
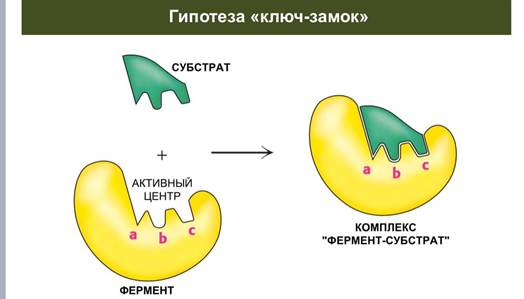
Гипотеза ключ-замок
Теория Фишера 1890 г. (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
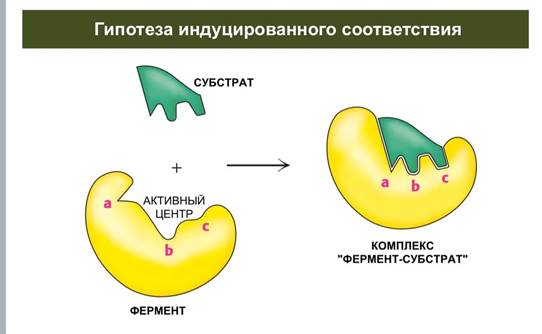
Гипотеза индуцрованного соответствия
В 1958 г. Дениел Кошланд предложил модификацию модели «ключ-замок». Ферменты, в основном, — не жесткие, а гибкие молекулы. Активный центр фермента может изменить конформацию после связывания субстрата. Боковые группы аминокислот активного центра принимают такое положение, которое позволяет ферменту выполнить свою каталитическую функцию. В некоторых случаях молекула субстрата также меняет конформацию после связывания в активном центре. В отличие от модели «ключ-замок», модель индуцированного соответствия объясняет не только специфичность ферментов, но и стабилизацию переходного состояния. Эта модель получила название «рука-перчатка».