1) Получение безводной соли
Для получения безводной соли взяли 10,000 г пентагидрата сульфата меди и прокалили в стаканчике 50 мл при 180 С в течении 30 мин, далее навеску поместили в эксикатор для остывания и взвесили, масса после прокалки составила 6,615 г, после повторной прокалки в течении 10 мин 6,614, масса изменилась не значительно, принимаем, что прокалка прошла полностью. Рассчитаем степень прокалки:
Масса навески пентагидрата сульфата медиmCuSO4·5H2O=10,000 г, количество молей nCuSO4·5H2O= mCuSO4·5H2O/MCuSO4·5H2O=10,000/250=0,040 моль, значит воды содержится mH2O= 5·nCuSO4·5H2O·18=3,6 г, значит масса безводного сульфата меди mCuSO4·5H2O- mH2O=10,000-3,6=6,400 г.
Масса прокаленного остатка mCuSO4практ=6,140 г, mCuSO4теор=6,400, относительная погрешность

Что бы сократить время выполнения работы остановимся на этой степени прокалки.
2) Определение теплоты растворения безводной соли
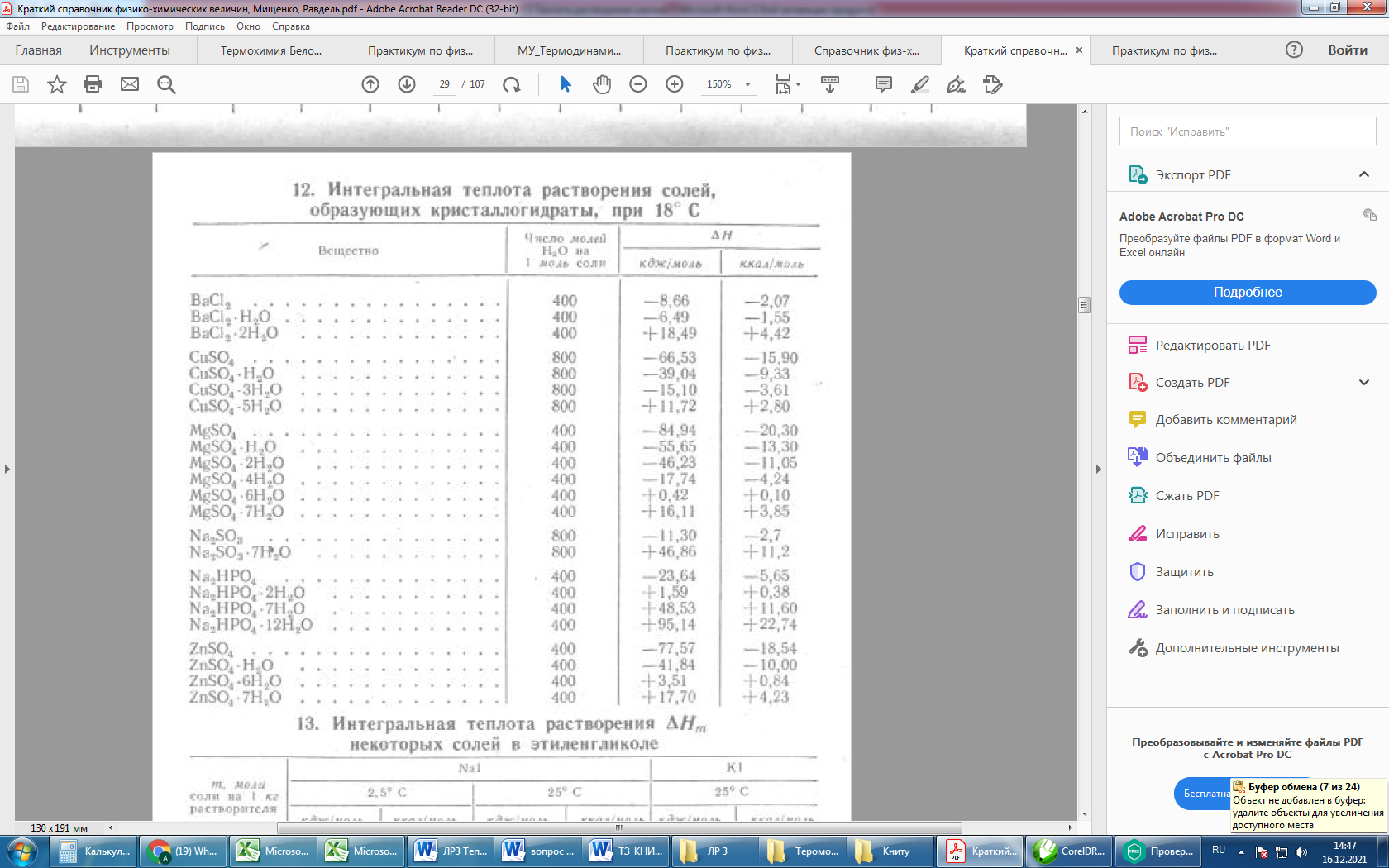
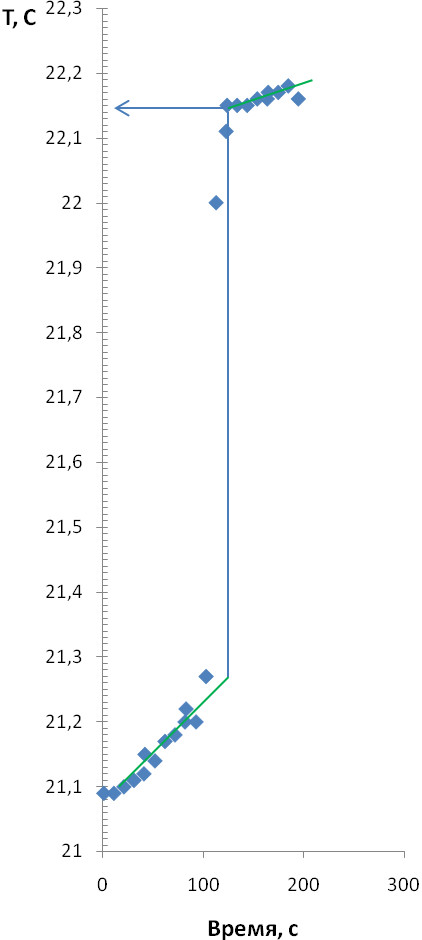
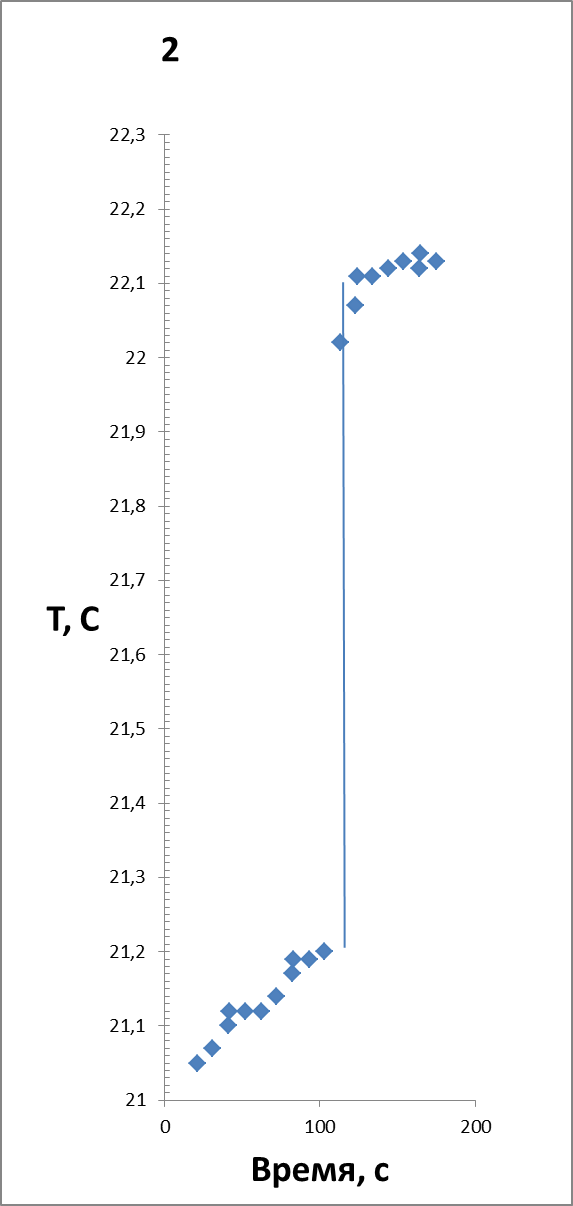
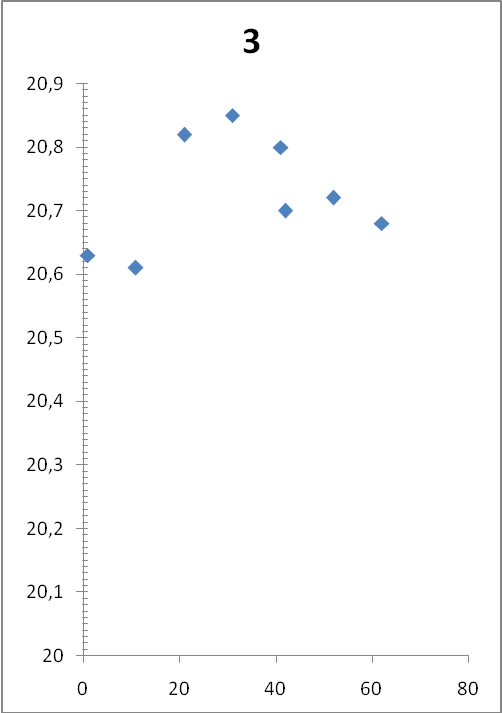
Растворили 2 грамма тонкоизмельченной в ступке безводной соли сульфата меди, термограммы двух параллельных опытов представлены на рисунке 2.
Найдем теплоту растворения по формуле
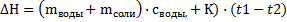
ΔH —тепловой эффект реакции, Дж.
К — постоянная калориметра;
ΔT — действительное изменение температуры процесса растворения
mс — масса соли, г;
mв— масса воды, г;
c — теплоемкость раствора (теплоемкости разбавленных растворов неорганических солей в воде практически одинаковы и незначительно отличаются от теплоемкости воды: cp = 4,18 Дж/(г·К)).
В таблице 1 приведены данные опыта
| № п/п | mводы, г | mсолиг | C, Дж/г | K | t1, ˚C | t2, ˚C | ΔH,Дж | |
| Безводная соль | ||||||||
| Опыты на ртутном термометре 0,1 С | 4.18 | 21,1 | 23,1 | -821 | ||||
| 4.18 | 21,1 | 23,1 | -867 | |||||
| Опыты на ПТС Pt1000 | 4.18 | 21,25 | 22,15 | -411 | ||||
| 4.18 | 21,22 | 22,10 | -402 | |||||
| Пентагидрат | ||||||||
| Опыты на ртутном термометре 0,1 С | 3,125 | 4.18 | 22,0 | 21,9 | ||||
| 3,125 | 4.18 | 21,8 | 21,7 | |||||
| Опыты на ПТС Pt1000 | Не удалось снять данные | |||||||
|
|
Пересчитаем полученный тепловой эффект 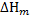 к размерности кДж/кг, по формуле:
к размерности кДж/кг, по формуле:
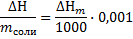
Где 0,001 – коэффициент для перевода кДж
И 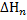 к размерности кДж/моль, по формуле
к размерности кДж/моль, по формуле
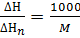 ,
,
где M – молярная масса (MCuSO4·5H2O=250 г, MCuSO4=160 г).
Теплоту гидратообразования найдем из закона Гесса
Уравнение №1, растворение безводной соли: CuSO4 (тв)→CuSO4(раст-р), ΔH1
Уравнение №2, растворение пентагидрата:CuSO4·5H2O→ CuSO4 (раст-р)+5 H2O, ΔH2
Найдем теплоту гидратообразованияCuSO4 (тв)+ 5H2O→CuSO4·5H2O, ΔH3.
Вычтем из уравнения №1 уравнение №2
CuSO4(тв)- CuSO4 (тв)· 5H2O= CuSO4 (раст-р)- CuSO4 (раст-р)-5 H2O
CuSO4(тв)- CuSO4 (тв)· 5H2O= CuSO4 (раст-р)- CuSO4 (раст-р)-5 H2O
CuSO4(тв) +5 H2O→CuSO4 (тв)· 5H2O.
ΔH3= ΔH1- ΔH2
Справочные данные интегральных теплот растворения приведены на рисунке 5, для сульфата меди -77 кДж/моль, мольное соотношение и температуру опустим с увеличением ошибки.
Сведем полученные данные с расчетом относительной ошибки
Таблица 2
| № п/п | Q кДж/кг | Q кДж/моль | |
| Безводная соль | |||
| Опыты на ртутном термометре 0,1 С | -411 | -65,7 | |
| -434 | -69,4 | ||
| Опыты на ПТС Pt1000 | -205 | -32,9 | |
| -201 | -32,1 | ||
| Пентагидрат | |||
| Опыты на ртутном термометре 0,1 С | 11,5 | ||
| 11,5 | |||
| Опыты на ПТС Pt1000 | Не удалось снять данные | ||
Таблица 3
| Q гидр, кДж/моль | δ, % | δсред, % | |
| Опыты на ртутном термометре 0,1 С | -77 | 0,31 | 2,69 |
| -81 | 5,06 | ||
| Опыты на ПТС Pt1000 | -44 | 42,36 | 42,83 |
| -44 | 43,31 |
|
|
Критерии оценивания лабораторной работы в зависимости от полученной относительной погрешности
| Рекомендуемая оценка, балл | |||
| Погрешность, % | <3 | 3,1-5 | >5 |
|
| ||||
| Термограмма опыта №3 | Термограмма опыта №4 |
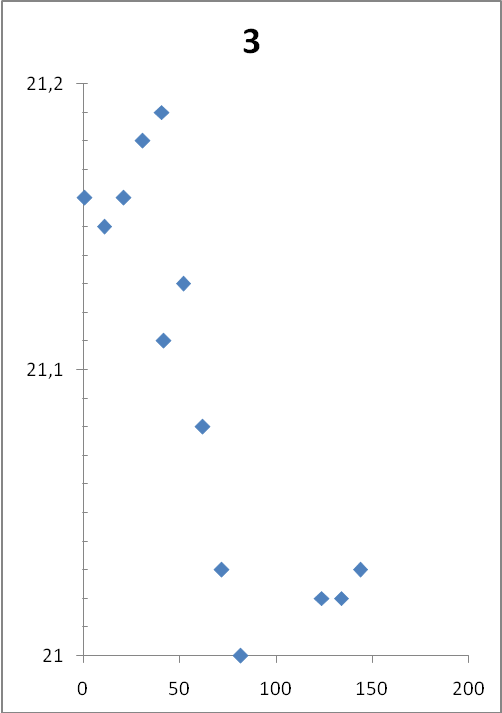
| 
|
| Термограмма опыта №7 | Термограмма опыта №8 |