Механизм активации молекулярного кислорода в активных центрах ферментов можно проиллюстрировать на примере цитохрома Р450. Цитохром Р450 является монооксигеназой, способной окислять с использованием молекулярного кислорода даже такие химически относительно инертные субстанции как насыщенные углеводороды. Активный центр этого фермента содержит геминовую группировку – железо-порфириновый комплекс. В результате взаимодействия цитохрома Р450 с О2 в активном центре фермента образуется π-катионный радикал порфирина (Р+·) и монокислородный комлекс железа. Последний по своей структуре подобен широко известным в химии окислителям – оксокомплексам и оксосолям металлов (например, перманганатам и бихроматам), и представляет собой феррил: FeIV=O. Аналогичная оксо- феррильная группировка, как уже упоминалось выше, присутствует и в активном центре высокоактивных форм пероксидаз. Процесс образования такого сильного окислителя в активном центре цитохрома Р450 является более сложным, чем у пероксидаз (см. функциональная роль активных метаболитов кислорода в системе защитных реакций организма). Для своей реализации он требует переноса электрона от внешнего источника (для перевода геминового железа FeIII в гемовое FeII, обеспечивающего связывание молекулы О2) и осуществляется через разложение перекисного интермедиата:
e- O2,H+ H+
P-FeIII ® P-FeII ® P-FeIII-OOH ® P+.-FeIV=O + H2O.
В результате активный центр этого фермента приобретает оксеноидные свойства, то есть может рассматриваться как комплекс атома кислорода (оксена) с железо-порфирином, окислительные свойства которого усилены π-катионным радикалом. Как и в случае других оксеноидов, упомянутых выше (перманганаты и бихроматы), атом кислорода оксо- феррильного комплекса может переноситься на субстрат (например, алканы):
P+·-FeIV=O + RH ® P-FeIII + ROH.
π-Катионный радикал порфирина образуется в каталитическом цикле и у геминовых пероксидаз – ферментов, специализированных, как уже отмечалось, для окислительной трансформации и метаболизма в организме наиболее устойчивых к окислению эндогенных и экзогенных веществ.
На основе металл-комплексных соединений в процессе эволюции живых систем был сформирован и механизм, обеспечивающий возможность реализации аэробными формами жизни маловероятного события: четырехэлектронного восстановления кислорода до воды. Механизм этот реализуется цитохромоксидазой. Цепь событий в активном центре данного фермента может быть изображена следующим редокс-циклом (где главными участниками являются железо и медь):

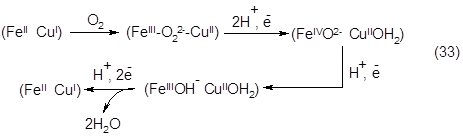
Возможность осуществления в живых организмах процессов неконтролируемого окисления органических субстратов молекулярным О2 сведена к минимуму, так как за счёт специализированных и обычных хелатных систем в организме, экстремально снижена концентрация свободных ионов металлов даже в сравнении со следовыми количествами их примесей в химических системах (порядка 10 нМ). В первую очередь это касается железа как наиболее распространенного металла переменной валентности в живых организмах.
В организме связывание железа обеспечивается специализированными биокомплексами (металлопротеидами). Однако существуют они и в слабо хелатированном состоянии, образуя неспецифические комплексы с высоко- и низкомолекулярными структурами. В первом случае в качестве неспециализированных носителей таких ионов могут выступать ДНК, белки, полярные группировки фосфолипидов, во втором – различные органические кислоты (например, цитрат) и другие низкомолекулярные соединения. Среди последних основная роль принадлежит молекулам, элементами структуры которых являются фосфатные группировки (АТФ, АДФ, ГТФ, НАДН+ и др.). Отличительной особенностью неспецифических металлорганических комплексов по сравнению с металлопротеидами является их значительно более высокая склонность к самопроизвольным редокс-превращениям с образованием АФК. В специализированных комплексах связывание этого химического элемента обеспечено тем, что он входит в состав железопорфириновых комплексов, выступающих активными центрами ферментов (пероксидаз, каталаз, цитохромоксидазы и др.), цитохромов и белков-переносчиков кислорода (гемоглобина и миоглобина), а также в состав железо-серных комплексов - активных центров таких ферментов как, например, ксантиндегидрогеназа (ксантиноксидаза), NADH-дегидрогеназа и другие. В тканях ионы этого элемента (Fe3+) депонируются в виде белкового комплекса с ферритином, переносятся в крови и внеклеточной жидкости в соединении с трансферрином и лактоферрином, а также аккумулируются в митохондриях в виде нерастворимых гранул гемосидерина.
Из общего содержания железа в организме человека (3-5 г), 70% сосредоточено в эритроцитах (его концентрация в этих клетках около 20 мМ). В остальных тканях уровень железа составляет около 0.3 мМ (это его резервные формы в виде комплексов с белками (ферритином, трансферрином и др.)). Суммарная концентрация ионов железа в ферментах и электронтранспортных цепях не превышает 0.01 мМ, хотя его локальные концентрации могут быть значительно выше.
Наличие в организме ионов железа, а также ионов других металлов переменной валентности, в иммобилизованном виде является эволюционно отобранным признаком и может служить в качестве конститутивного фактора системы антиоксидантной защиты (см. Система антиоксидантной защиты организма). Даже незначительное повышение концентрации свободных ионов металлов переходной группы в организме провоцирует нежелательные реакции молекулярного кислорода и его интермедиатов, что выступает в качестве одного из патогенетических факторов при заболеваниях, связанных с так называемым окислительным стрессом.
Поэтому существование in vivo свободных ионов железа (Fe2+ - как его растворимой формы), хотя бы и внутри замкнутых мембранных компартментов, маловероятно. Тем более, что в липидной фазе растворимость молекулярного кислорода почти на порядок превышает его растворимость в водных растворах. Двухвалентные же ионы железа легко взаимодействуют с О2, выступая для последнего донорами электронов. Результатом такого взаимодействия является образование супероксидного анион-радикала (О2-·), а также последующая цепь реакций, описанная выше.
В химических реакциях такого типа (с механизмом попеременного окисления-восстановления иона металла) - скорость-лимитирующей стадией является окисление субстрата металлом, находящимся в высшей степени окисления. Значительно реже встречаются реакции, в которых самая медленная стадия представлена окислением восстановленной формы иона металла. Именно поэтому основным источником образования свободнорадикальных форм АФК (НО·) в организме и выступает ион Fe2+.