Во сколько раз уменьшится концентрация раствора при добавлении 15 мл воды к 10 мл 0,1 М раствора СН3СООН?
2)На титрование пробы столового уксуса затрачено 10,50мл 0,0150 М раствора NaOH. Рассчитать массу (мг) CH3COOH в анализируемой пробе уксуса.
3)Рассчитать рН 0,02 М раствора муравьиной кислоты, рКHCОOH=3,75
Рассчитать массу (г) уксусной кислоты в 400 мл раствора с титром 0,348 мг/мл
5)Вычислить содержание (моль) безводной щавелевой кислоты в 20,0 мл раствора с концентрацией C(Н2С2О4) = 0,5 моль/л
6 Основное свойство буферных растворов заключается в:
Сохранении неизменным рН при любых условиях
Сохранении рН практически неизменным при добавлении сильных кислот и оснований
Сохранении неизменным рН при разбавлении
сохранении практически неизменным рН при добавлении солей
| При добавлении к кислому буферу небольшого количества щёлочи его pH… 1) Не меняется 2) Незначительно увеличивается 3) Незначительно уменьшается 4) Значительно возрастает |
| При добавлении к щелочному буферу небольшого количества сильной кислоты его pH… 1) Не меняется 2) Незначительно увеличивается 3) Незначительно уменьшается 4) Значительно уменьшается |
| При добавлении к щелочному буферу небольшого количества щёлочи его pH… 1) Не меняется 2) Незначительно увеличивается 3) Незначительно уменьшается 4) Значительно увеличивается |
| При добавлении к кислому буферу небольшого количества сильной кислоты его pH… 1) Не меняется 2) Незначительно увеличивается 3) Незначительно уменьшается 4) Значительно увеличивается |
| При добавлении к кислому буферу небольшого количества сильной кислоты его pH меняется незначительно, т. к… 1) Сильная кислота нейтрализуется солью 2) Сильная кислота нейтрализуется слабой кислотой 3) Сильная кислота разбавляется буферным раствором 4) Сильная кислота нейтрализуется слабым основанием |
| При добавлении к кислому буферу небольшого количества сильного основания его pH меняется незначительно, т.к 1) Сильное основание нейтрализуется сильной кислотой 2) Сильное основание нейтрализуется слабой кислотой 3) Слабая кислота нейтрализуется слабым основанием 4) Сильное основание нейтрализуется солью |
| При добавлении к щелочному буферу небольшого количества сильной кислоты его pH меняется незначительно, т. к 1) Сильная кислота нейтрализуется слабым основанием 2) Слабое основание нейтрализуется солью 3) Сильная кислота нейтрализуется солью 4) Сильная кислота нейтрализуется сильным основанием |
| При смешивании 2 л 0,05 М раствора аммиака и 1 л 0,1 М раствора хлорида аммония рН смеси равен… 1) 0,1 2). 0,05 3). pК NH3 4). 14- pК NH3 |
Какое из выражений правильно для определения концентрации ионов водорода в растворе уксусной кислоты?
1)[Н+]=Кд.Ск-ты
2) [Н+]=  3) [Н+]= Ск-ты
4) [Н+]=
3) [Н+]= Ск-ты
4) [Н+]= 
|
| Вычислите значения рН раствора состоящего из 80 мл 0,1 М раствора NaНСО3 и 20 мл 0,2 М Na2СО3 (Kа1(H2СO3) = 4,5.10 -7; Kа2(H2СO3) = 4,8.10 -11). |
| Вычислите значения рН раствора 0,01 М HF (Ka = 6,2.10-4) |
| Вычислите значения рН раствора 0,3 М LiOH |
| При концентрации гидроксид ионов 0,008 моль/л рН равен 1). 9,3 2). 2. 10,2 3). 3. 11,9. |
Рассчитать рН 0,01 М раствора уксусной кислоты, если рКСH3CОOH = 4,75
10,25 2). 2,75 3). 2,87 4). 1,70
Перед заполнением бюретки раствором титранта для анализа ее ополаскивают:
1) минимум два раза дистиллированной водой;
2) минимум два раза рабочим раствором;
3) минимум по два раза дистиллированной водой и рабочим раствором.
| Раствор соляной кислоты не может использоваться в качестве первичного стандарта из-за: 1). малой молекулярной массы эквивалента 2). летучести 3). участия в окислительно-восстановительных реакциях 4). может использоваться 5). неустойчивости | |
| Укажите схему расчета количества вещества в случае использования обратного титрования (А - аналит, В- титрант, С- вспомогательный реагент): 1). n(A) = n(C) - n(B) 2). n(A) = n(B) - n(C) 3). n(A) = n(B) 4). n(A) = n(C) | |
Молярная масса эквивалента серной кислоты в реакции Н2SO4 + NaOH = NaHSO4 + H2O рассчитывается:
1) 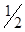 ∙ M (Н2SO4)
2) 1∙ M (Н2SO4) ∙ M (Н2SO4)
2) 1∙ M (Н2SO4)  3) 2 ∙ M (Н2SO4)
3) 2 ∙ M (Н2SO4)
| |
Если точную концентрацию раствора КОН устанавливают по результатам титрования раствором КОН раствора щавелевой кислоты Н2С2О4, то СЭКВ(КОН) рассчитывают по формуле:
1)  2)
2)  3)
3) 
| |
| Вычислить титр 0,01 М раствора серной кислоты: 1).4,900 • 10-4 2). 0,490000 3). 9,80•10–4 | |
| На титрование 0,2500г чистого Na2CO3 затрачено 20,50 мл раствора HNO3. Вычислить молярную концентрацию титранта. 1). 0,4602 2). 0,2301 3). 0,1155 4).нет правильного ответа | |
| Рассчитать концентрацию раствора уксусной кислоты с титром 0,016000 мг/мл: 1). 1,33•10-3 М 2). 26,7•10-3 М 3). 2,67•10-3 М 4). 0,267•10-3 М | |
| Вычислить титр 0,01 М раствора Н2С2О4 1). 0,045000 2). 0,450000 3). 0,000450 4). 0,900000 | |
| Рассчитать рН 0,01 М раствора муравьиной кислоты, рКHCОOH=3,75 1). 11,12 2). 2,88 3). 12,30 4). 8,25 | |
| Рассчитать титр (г/мл) 0,02 М раствора уксусной кислоты 1). 1,2•10-3 2). 12,0•10-3 3). 0,6•10-3 4). 6,0•10–3 | |
| 5). слабого основания сильной кислотой | |
| На титрование 200,0мл воды израсходовано 3,45мл раствора HCl, титр которого равен 0,004023г/мл. Определить карбонатную жесткость анализируемой воды 1). 0,0139 ммоль-экв/л 2). 1,90 ммоль-экв/л 3). 0,0019 ммоль-экв/л 4). 0,0694 ммоль-экв/л 1). 2 | |
| Титр 0,120 н раствора серной кислоты равен 1). 0,0074 г/мл; 2). 0,0234 г/мл; 3). 1,007 г/мл; 4). 0,00590 г/мл | |
| Рассчитать титр 0,15М раствора HCl | |
| Рассчитать титр 0,11М раствора NaОН | |
| Рассчитать титр 0,09М растворабуры Nа2В4О7 ·10Н2О | |
| Рассчитать титр 0,17М раствора CH3COOH | |
| Рассчитать титр 0,25М раствора КОН | |
| Рассчитать титр 0,33М раствора HNO3 | |
| Титр 0,10 н раствора соляной кислоты равен 1). 0,03704 г/моль 2). 0,075 г/моль 3). 0,00015 г/моль | |
| Молярная масса эквивалента карбоната натрия в реакции Na2CO3 + 2HCl = NaCl + СО2 + Н2О равна: 1) 53 г/моль 2) 106 г/моль 3) 212 г/моль 4) 36 г/ моль 5) 318 г/моль |