ЗАДАНИЕ К УРОКУ № 41,42
Дата 24.12.2020 Группа п-201
Дисциплина: Химия
Темы уроков: ЛР Приготовление жесткой воды и устранение ее жесткости
Приготовление раствора заданной концентрации
План занятия:
1. Посмотрите видео устранения жесткости воды https://youtu.be/4_0yPavn36U
2. Вспомните, что изучали в 9 классе (лекцию прилагаю)
3. По желанию
Оформите себе в тетрадь (как делали в школе)
Тема ЛР, цель, оборудование
Перенесите таблицу (1, 2 столбик) к себе в тетрадь (третий заполните уравнения, если не знаете, оставте пустым) из задания отмеченного желтым цветом. Запишите вывод по просмотренному видео.
4. Если получилось сделать ЛР (оформить уравнения). Молодцы. Если нет пройдите тест по ссылке https://docs.google.com/forms/d/1j8Un5oPlH4guXKAnj_RtUyJgaTwinQrUhhuaRoY8HqI/edit
5. Фото ЛР или ответов теста прошу выслать в вк.
6. Прошу сделать сегодня
ВЫХОДНОЙ ТЕСТ ПО ТЕМЕ «ЖЁСТКОСТЬ ВОДЫ» (тест есть в ссылке)
1. ВРЕМЕННАЯ ЖЕСТКОСТЬ ВОДЫОБУСЛОВЛЕНА
а) Са(НСО3)2 г) Mg(HCО3)2
б) CaSО4 д) MgSО4
в) MgCl2 e) СаС12
2. ПОСТОЯННАЯ ЖЁСТКОСТЬ ВОДЫОБУСЛОВЛЕНА НАЛИЧИЕМ
а) Са(НСО3)2 г) Mg(HCО3)2
б) CaSО4 д) MgSО4
в) MgCl2 e) СаС12
3. КАК СМЯГЧИТЬ ВОДУ С ПОСТОЯННОЙ ЖЕСТКОСТЬЮ
А) добавить соду Na2CО3
б) кипячением
в) добавить известковую воду Са(ОН)2
г) использовать иониты
д) добавить уксус
4. КАК СМЯГЧИТЬ ВОДУ С ВРЕМЕННОЙ (КАРБОНАТНОЙ) ЖЁСТКОСТЬЮ?
а) добавить соду Na2CО3
б) кипячением
в) добавить известковую воду Са(ОН)2
г) использовать иониты
д) добавить уксус
5. КАК СМЯГЧИТЬ ВОДУ С ОБЩЕЙ (КАРБОНАТНОЙ И НЕКАРБОНАТНОЙ) ЖЁСТКОСТЬЮ? а) добавить соду Na2CО3
б) кипячением
в) добавить известковую воду Са(ОН)2
г) использовать иониты
д) добавить уксус
6. КАКУЮ ОПАСНОСТЬ ПРЕДСТАВЛЯЕТ НАКИПЬ, КОТОРАЯ ОБРАЗУЕТСЯ В ТОПОЧНЫХ КОТЛАХ?
а) вызывает коррозию металла
б) вызывает преждевременный износ котла
в) вызывает перерасход топлива
7. УРАВНЕНИЯ РЕАКЦИЙ, В РЕЗУЛЬТАТЕ КОТОРЫХ УСТРАНЯЕТСЯ ВРЕМЕННАЯ ЖЁСТКОСТЬ
а) CaSО4 + Na2CО3 = CaCО3↓+ Na2CО3
б) Са(НСО3)2 = CaCО3↓ + СО2↑ + Н2О
в) Mg(HCО3)2 = MgCО3↓ + CО2↑+ Н2О
г) MgCl2 + Na2CО3 = MgCО3↓ + 2NaCl
8. УРАВНЕНИЯ РЕАКЦИЙ, В РЕЗУЛЬТАТЕ КОТОРЫХ УСТРАНЯЕТСЯ ПОСТОЯННАЯ ЖЁСТКОСТЬ
а) CaSО4 + Na2CО3 = CaCО3↓ + Na2CО3
б) Са(НСО3)2 = CaCО3↓ + C02↑ + H2О
в) Mg(HCО3)2 = MgCО3↓ + CО2↑ + Н2О
г) MgCl2 + Na2CО3 = MgCО3↓ + 2NaCl
ИНСТРУКЦИОННО-ТЕХНОЛОГИЧЕСКАЯ КАРТА
НА ВЫПОЛНЕНИЕ ЛАБОРАТОРНОЙ РАБОТЫ
Тема: Приготовление жесткой воды и устранение ее жесткости.
Цель: закрепление знаний по теме «Растворы. Приготовление растворов с определенной массовой долей растворенного вещества», формирование понятия «жесткость» воды, развитие умений по устранению жесткости воды; продолжить формирование умения проводить химические реакции.
Оборудование: набор реактивов и лабораторной посуды для проведения реакций.
Нормы времени: 2 часа.
Литература:
1) страница 62-68. Тупикин Е.И. Химия в строительстве: учебное пособие для ССУЗов/ Е.И.Тупикин. – М.: Дрофа, 2015. – 174 с., ил.
2) страница 82-85. Габриелян О.С. Химия. 11 класс. Базовый уровень: Учебник для общеобразовательных учреждений. – 8-е изд. стереопит. – М.: Дрофа, 2015. – 223, [1]с.: ил.
Краткое содержание темы:
Воду с растворенными в ней солями называют жесткой, а совокупность свойств такой воды – жесткостью. Жёсткость воды – свойство воды, связанное с содержанием растворимых в ней соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде. Жесткая вода образует накипь на стенках паровых котлов, отопительных приборов и бытовой металлической посуды. Она не пригодна для производства бумаги и крашения тканей, для приготовления пищи и напитков. В жесткой воде плохо развариваются овощи и мясо, не пенится мыло. Мыла – это натриевые и калиевые соли органических кислот (C17H35COONa, C17H35COOK). С катионами кальция и магния анионы кислотных остатков образуют нерастворимые соли, и мыло расходуется при этом бесполезно. В настоящее время химическая промышленность выпускает большое количество различных синтетических моющих средств (стиральных порошков), содержащих насыщенную углеводородную цепь из 10...15 атомов углерода, так или иначе связанную с сульфатной или сульфонатной группой, например:
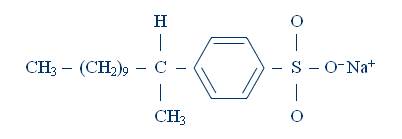
Они, как правило, не образуют малорастворимых в воде солей кальция и магния. Запись СМС можно упростить: R-SO3-Na.
Согласно ГОСТ 6055 – 86 различают:
§ карбонатную жесткость – это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальция, магния и железа. Часто этот вид жесткости называют временной или устранимой;
§ некарбонатную жесткость – совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция, магния и железа. Этот вид жесткости также называют постоянной или неустранимой;
§ общую жесткость, складывающуюся из карбонатной и некарбонатной жесткости. Она равна сумме концентраций ионов Са2+, Mg2+, Fе2+.
За единицу жесткости принимают жесткость воды в одном литре которой содержится один миллимоль (ммоль) эквивалент ионов Са2+ или Mg2+. Числовое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м3. Одна единица жесткости соответствует массовой концентрации ионов Са2+, равной 20,4 мг/л или ионов Mg2+, равной 12,15 мг/л.
По величине жесткости различают воду:
§ очень мягкую < 1, 5 единиц (ммоль экв/л);
§ мягкую 1, 5 – 3 единиц;
§ среднюю 3, 6 – 6, 0 единиц
§ жесткую 6, 0 – 9, 0 единиц
§ очень жесткую > 9, 0 единиц.
Методы устранения и снижения жесткости воды. Устранение или снижение жесткости воды называют умягчением. Его осуществляют различными методами.
1. Метод кипячения. Он позволяет устранить только временную (карбонатную) жесткость, обусловленную наличием в воде хорошо растворимых гидрокарбонатов кальция, магния и железа. При этом катионы Са2+, Mg2+, Fe2+ осаждаются в виде нерастворимых соединений.
2. Химическая обработка воды (реагентный метод). Этот метод позволяет устранить как временную жесткость, так и постоянную. Сущность его заключается в обработке воды специальными реагентами, образующими ионами, вызывающими жесткость, малорастворимые соединения. К числу таких реагентов относятся: сода Na2CO3, негашеная CaO и гашеная Ca(OH)2 извести, различные фосфаты натрия (Na3PO4, Na6P6O18) и др. Обработка известью позволяет связать и растворенный в воде углекислый газ. Использование фосфатов натрия предпочтительнее, так как образующие фосфаты кальция, магния и железа менее растворимы, чем соответствующие их карбонаты и гидроксиды.
3. Ионообменный метод. Это современный физико – химический метод основан на способности некоторых веществ, не растворимых в воде, стехиометрически обменивать свои ионы на ионы внешней среды (воды, растворов электролитов). Вещества, обладающие такими свойствами, называют ионообменниками (ионообменными сорбентами) или сокращенно ионитами. Большинство ионитов – твердые, ограниченно набухающие вещества, аморфной или кристаллической структуры. Они состоят из каркаса (матрицы) и закрепленных на нем иогенных (активных функциональных) или комплексообразующих групп.
Задание:
1. Переписать в тетрадь все пункты раздела "Содержание работы и последовательность выполнения".
2. Посмотреть реакции в видео и записать уравнения.
3. В выводе указать наблюдаемые изменения.
| № | Содержание работы и последовательность выполнения | Применяемое оборудование и материалы | Инструкционные указания и требования |
| 1. | Приготовьте воду с временной, карбонатной жесткостью (содержит гидрокарбонат кальция). Разделите содержимое на 6 пробирок. | Пробирки, вода, Са(НСО3)2 | Запишите уравнения реакции в ионной форме. |
| 2. | Налить в 2 пробирки по 1 мл жесткой воды, в одну добавить по каплям раствор мыла, в другую раствор СМС. Взболтать содержимое пробирок. | Пробирки, растворы мыла и порошка, жесткая вода | Проделать опыт, записать уравнения реакции в ионной форме и наблюдения |
| 3. | Проведите опыт по устранению временной, карбонатной жесткости воды кипячением. Повторите опыт №2. | Пробирки, спиртовка, спички, растворы мыла и порошка, жесткая вода | Проделать опыт, записать уравнения реакции и наблюдения |
| 4. | Проведите опыты по устранению временной, карбонатной жесткости воды добавлением гашеной извести. Проведите опыт №2. | Пробирки, растворы мыла и порошка, жесткая вода, Са(ОН)2 | Проделать опыт, записать уравнения реакции в ионной форме и наблюдения |
| 5. | Получите воду с постоянной, некарбонатной жесткостью (cодержит сульфат магния). Разделите содержимое на 4 пробирки. Проведите опыт №2. | Пробирки, MgSO4, растворы мыла и порошка, жесткая вода | Проделать опыт, записать уравнения реакции в ионной форме и наблюдения |
| 6. | Проведите опыт по устранению постоянной, некарбонатной жесткости воды добавлением соды (карбоната натрия). Проведите опыт №2. | Пробирки, растворы мыла и порошка, жесткая вода, NaCO3 | Проделать опыт, записать уравнения реакции в ионной форме и наблюдения |
| 7. | Налить в 2 пробирки растворы мыла и стирального порошка, добавить несколько капель раствора фенолфталеина | 2 пробирки, растворы мыла и порошка, раствор фенолфталеина | Проделать опыт, записать наблюдения в тетрадь |
Критерии оценки, формы отчета: письменный отчет с планом определения вещества, с описанием наблюдений.