Введение
За последние десятилетия созданы сотни установок электролиза воды для получения водорода и кислорода, оборудованных электролизерами, которые работают как при атмосферном, так и при повышенном давлении. В настоящее время только на электростанциях работает около тысячи электролизеров различного типа.
Для удовлетворения нужд народного хозяйства в электролитическом водороде в ближайшие годы дополнительно потребуется значительное количество мощных электролизеров производительностью по 500 - 650 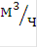 водорода и более мелких электролизеров для выработки небольших количеств водорода.
водорода и более мелких электролизеров для выработки небольших количеств водорода.
Во многих странах электролизные установки использовались для получения тяжелой воды в качестве побочного продукта. В последующем были разработаны более эффективные методы её производства, однако побочное получение побочной воды на крупных электролизных установках в ряде случаев целесообразно.
Общие сведения о процессе электролиза воды
Как известно, при прохождении электрического тока через растворы электролитов на электродах происходит разряд ионов и протекают связанные с этим химические реакции. Протекания процесса электролиза определяется переносом электрического тока в жидкости и условиями разряда присутствующих в растворе ионов электролита.
Процесс электролиза воды с получением водорода и кислорода описывается следующим суммарным уравнением:
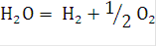
Чистую воду нельзя непосредственно подвергать электролизу, так как её электропроводность очень мала. Удельная электропроводность водопроводной воды близка к 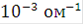 *
* 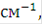 очень чистой дистиллированной воды около 4*
очень чистой дистиллированной воды около 4* 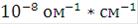 . Поэтому при электролизе применяют водные растворы электролитов - кислот, щелочей, солей.
. Поэтому при электролизе применяют водные растворы электролитов - кислот, щелочей, солей.
Изменяя состав, концентрацию и температуру электролита и подбирая условия, определяющие величину перенапряжения, можно изменять протекания электродных процессов в желательном направлении.
В промышленных процессах электролиза воды в настоящее время применяются только щелочные электролиты - едкое кали и едкий нарт. Если в качестве электролитов используются технический щелочи, в их растворах присутствуют примеси ионов 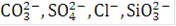 и т.д. Возможно также присутствие в электролите небольших количеств железа и других загрязнений.
и т.д. Возможно также присутствие в электролите небольших количеств железа и других загрязнений.
При длительной эксплуатации установок электролиза воды в растворе электролита накапливаются посторонние ионы, вносимые с примесями, содержащиеся в питательной воде. Если какая-либо примесь, например ионы 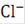 , постоянно поступает в раствор электролита, то при достаточной продолжительности процесса электролиза достигается предельная концентрация этой примеси, которая определяется из равенства её прихода и расхода в электролизере за единицу времени.
, постоянно поступает в раствор электролита, то при достаточной продолжительности процесса электролиза достигается предельная концентрация этой примеси, которая определяется из равенства её прихода и расхода в электролизере за единицу времени.
При питании электролизера дистиллированной водой содержание простых ионов в электролите обычно очень невелико и в сумме не превышает 1 - 5 г/л, исключая карбонаты, содержание которых в 1 л раствора электролита может достигать десятков граммов. В электролизерах с открытым зеркалом электролита, соприкасающимися с воздухом, концентрация карбонатов может быть ещё больше. Для электролизеров некоторых конструкций электролит приготавливают в герметичных баках с азотной подушкой, что предотвращает загрязнение его карбонатами.
При электролизе воды на катоде выделяется водород, аноде - кислород. В зависимости от условий ведения катодного процесса возможны два механизма его протекания. В кислых растворах с высоким содержанием ионов водорода его выделение происходит за счет разряда ионов 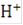 с образованием атомарного водорода, который адсорбируется на поверхности катода, что может быть описано выражением:
с образованием атомарного водорода, который адсорбируется на поверхности катода, что может быть описано выражением:
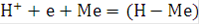
Поскольку ион водорода в растворе гидратирован, стадию его разряда можно представить в виде:
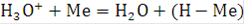
Следующая стадия катодного процесса - рекомбинация атомарного водорода в молекулярный протекающая по каталитическому механизму.
2 (Н - Ме) 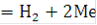
В определенных условиях обе стадии катодного процесса - разряд ионов 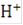 и выделение молекулярного водорода - могут протекать одновременно.
и выделение молекулярного водорода - могут протекать одновременно.
Если в растворе присутствуют другие катионы, имеющие более положительный потенциал выделения по сравнению с водородом, они выделяются на катоде, образуя осадок. Это наблюдается, например, при наличии в электролите примесей соединений свинца, олова, цинка, железа, хрома, молибдена и некоторых других металлов. В случае образования на катоде такого осадка могут изменятся потенциал выделения водорода и условия протекания катодного процесса. В промышленных условиях электролит практически всегда содержит небольшое количество ионов железа из - за постоянной коррозии стальных деталей электролизеров. Поэтому на катодной поверхности обычно образуется осадок в виде металлической (железной) губки.
Выделение на аноде кислорода при электролизе воды происходит в результате разряда гидроксильных ионов или молекул воды. Присутствующие в электролите небольшие количества 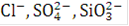 и других ионов, а также ионы
и других ионов, а также ионы 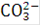 при достаточно высокой концентрации щелочи в растворе (200 - 300 г./л и более) не могут разряжаться, так как для этого в данных условиях необходим более высокий потенциал, чем для разряда ионов
при достаточно высокой концентрации щелочи в растворе (200 - 300 г./л и более) не могут разряжаться, так как для этого в данных условиях необходим более высокий потенциал, чем для разряда ионов 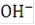 или молекул воды. В щелочных растворах при умеренных плотностях тока подвод ионов гидроксила к аноду не является лимитирующим процессом и они разряжаются на аноде по реакции:
или молекул воды. В щелочных растворах при умеренных плотностях тока подвод ионов гидроксила к аноду не является лимитирующим процессом и они разряжаются на аноде по реакции:
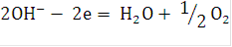
В кислых растворах при любых плотностях тока и в щелочных растворах при высоких плотностях тока подвод ионов 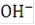 является лимитирующей стадией и для разряда их предложен второй механизм:
является лимитирующей стадией и для разряда их предложен второй механизм:
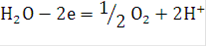
При электролизе в переносе тока принимают участие все находящиеся в электролите ионы. Доля их участия определяется относительной концентрацией и подвижностью ионов. В щелочных электролитах вследствие очень низкой концентрации ионов водорода перенос тока осуществляется почти исключительно ионами 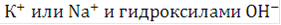 .
.
На катоде разряжаются практически только молекулы воды, на аноде - ионы 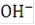 . При этом на каждую молекулу выделявшегося на катоде водорода распадается две молекулы воды с образованием двух молекул
. При этом на каждую молекулу выделявшегося на катоде водорода распадается две молекулы воды с образованием двух молекул 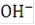 . Ионы
. Ионы 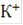 и
и 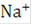 , участвующие в переносе тока к катоду, так же как
, участвующие в переносе тока к катоду, так же как 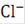 ,
, 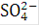 и другие анионы, участвующие в переносе тока к аноду, на электродах не разряжаются.
и другие анионы, участвующие в переносе тока к аноду, на электродах не разряжаются.
В связи с тем, что в процессе электролиза воды на обоих электродах выделяются газы, прилегающий к электроду слой электролита интенсивно перемешивается. Поэтому на поверхности анода маловероятно образование локальных зон с сильно пониженной концентрацией КОН и соответственно с повышенной концентрацией ионов 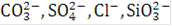 и др. Однако в глубине узких щелей между электродом и прилегающими к нему деталями или под шламом у поверхности электрода возможно значительное изменение концентрации ионов по ранее рассмотренным причинам. Такие концентрационные изменения, по-видимому, вызывают местную интенсивную электрохимическую коррозию некоторых деталей электролизеров.
и др. Однако в глубине узких щелей между электродом и прилегающими к нему деталями или под шламом у поверхности электрода возможно значительное изменение концентрации ионов по ранее рассмотренным причинам. Такие концентрационные изменения, по-видимому, вызывают местную интенсивную электрохимическую коррозию некоторых деталей электролизеров.
Как и в других электрохимических процессах, затраты электрической энергии при электролизе воды велики и часто определяют экономику этого процесса. Поэтому вопросам расхода энергии на электролиз и снижению величины напряжения на электролитической ячейки всегда уделяется большое внимание.