ФАКУЛЬТЕТ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
Кафедра «Химии и технологии переработки эластомеров»
Отчет по лабораторной работе:
«Катионная полимеризация стирола»
| Выполнил: Шефер А.А. | |
| Группа: | ХЕБО-10-13 |
| Руководитель: | Емельянов С.В. |
МОСКВА 2016
Введение
Полимеризация – процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера, олигомера) к активным центрам в растущей молекуле полимера.
В нашем случае рассматривается ионная полимеризация, протекает по механизму цепных реакций. Растущая цепь, рост которой завершается образованием макромолекулы полимера, имеет природу иона углерода-положительного-карбокатион или отрицатильного (карбанион). Процесс полимеризации под влиянием ионных катализаторов сильно зависит от полярности растворителя, протекает с большими скоростями и значительно меньшей энергией активации, полимеризация может осуществляться при температурах, доходящих до -100 °С.
Низкая температура, высокая скорость полимеризации и ориентирующее действие активного центра катализатора на молекулы мономера приводят к тому, что эти молекулы соединяются друг с другом в определенном порядке и тем самым могут образовывать:
· соединение только голова к хвосту
· полимеры с высокой молекулярной массы и сравнительно узкого молекулярно массового распределения.
Если более конкретно, то мы рассматриваем катионную полимеризацию (атом заряжен положительно).Обычно к катионной полимеризации относят все случаи образования полимера под действием катализаторов катионного типа, имеющих кислотный характер. В настоящее время наиболее широко применяются металлоорганические типа катализаторов Фриделя-Крафтса.
|
|
Ионные процессы обладают высокой чувствительностью по отношению к воде и различным примесям, находящимся в реакционной системе. Таким образом вода и некоторые другие вещества выполняют роль сокатализаторов.
Под действием катализаторов катионного типа полимеризуется широкий круг органических веществ. Все эти вещества можно разделить на два класса:
· ненасыщенные соединения, образующие полимеры за счет раскрытия двойных или тройных связей;
· циклические соединения, образующие линейные полимеры за счет разрыва цикла.
Катализатором катионной полимеризации являются сильные электроноакцепторные вещества:
· Катализаторы Фриделя-Крафтса: BF3, AlCl4, SnCl4, TiCl4, SbCl5 и др.
· Водородные кислоты: H2SO4, HCl, H3PO4 и др.
· Другие кислоты: I2 и ICl, IBr и др.
В настоящее время наиболее широко применяются металлоорганические соединения типа катализаторов Фриделя-Крафтса.
При ионной полимеризации обрыв цепи по отношению к растущему полимеру часто является реакцией первого порядка. Благодаря уменьшению подвижности макроиона вследствие увеличения его размеров, происходит отщепление протона от растущего полимера и присоединение его к противоположно заряженному иону, то есть рекомбинация аниона или регенерация катализатора.
Ионная полимеризация часто сопровождается реакциями передачи цепи: полимер, несущий заряд, одтает мономеру и растворителю протон, образуя полимер с двойной связью на конце.
Особенности кинетики катионной полимеризации состоят в том, что:
|
|
· суммарная скорость полимеризации прямо пропорциональна квадрату концентрации мономера и первой степени концентрации катализатора.
· степень полимеризации прямо пропорциональна первой степени концентрации мономера и не зависит от концентрации катализатора.
· общая энергия активации зависит в том числе от температуры—чем она ниже, тем выше скорость полимеризации.
Цель нашей работы: получение полистирола путем блочной полимеризации стирола под действием катализатора катионного типа и выделение его из реакционной системы осаждением, а также определение его молекулярной массы вискозиметрическим методом.
Объекты и методы исследования
Объекты:
Стирол – бесцветная жидкость со специфическим запахом. Он практически нерастворим в воде, хорошо растворим в органических растворителях, хороший растворитель полимеров.
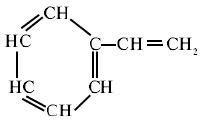
Получение:
Большую часть стирола в промышленности получают дегидрированием этилбензола при температуре 600—650°С, атмосферном давлении и разбавлении перегретым водяным паром в 3-10 раз. Используются оксидные железо-хромовые катализаторы с добавкой карбоната калия.
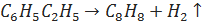
Другой промышленный способ, которым получают оставшиеся 15 %, заключается в дегидратации метилфенилкарбинола, образующегося в процессе получения оксида пропилена из гидропероксида этилбензола.Гидропероксид этилбензола получают из этилбензола некаталитическим окислением воздухом.
Свойства:
| Показатель | Величина |
| Молярный вес | 104,14 |
| Плотность при 20°С, г/см3 | 0,90630 |
| Молярный объем при 20°С, см3/моль | 114,945 |
| Показатель преломления, nd20 | 1,5465 |
| Динамическая вязкость | 0,781 |
| Поверхностное натяжение при 20°С, дин/см | 32,2 |
| Дипольный момент, D | 0,37 |
| Температура, 0 С Кипения Плавления | 145,2 -30,63 |
Стирол легко окисляется, присоединяет галогены, полимеризуется (образуя твердую стекловидную массу — полистирол) и полимеризуется с различными мономерами. Полимеризация происходит уже при комнатной температуре (иногда со взрывом), поэтому при хранении стирол стабилизируют антиоксидантами. Галогенированиев отличие от анилина идёт не по бензольному кольцу, а по виниловой группе.
|
|
Применение:
Стирол применяют в основном для производства полимеров. Многочисленные виды полимеров на основе стирола включают полистирол, пенопласт (вспененный полистирол), модифицированные стиролом полиэфиры, пластики АБС (акрилонитрил-бутадиен-стирол) и САН (стирол-акрилонитрил). Также стирол входит в состав напалма.
Стружка из полистирола, растворенная в стироле, образует идеальный клей для полистирола: под действием тепла и остатков полимеризаторов клеевой шов достаточно быстро полимеризуется и полностью исчезает, таким образом 2 детали превращаются в единый монолит.
Реагенты:
1) Гидроксид натрия, NaOH (очиститель) – белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты.
Получение:
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
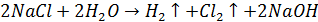
Применение:
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
· Каустик применяется в целлюлозно-бумажной промышленности для делигнификации целлюлозы, в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит.
· Для омыления жиров при производстве мыла, шампуня и других моющих средств.
· В химических отраслях промышленности — для нейтрализации кислот и кислотных оксидов, как реагент или катализатор в химических реакциях, в химическом анализе для титрования, для травления алюминия и в производстве чистых металлов, в нефтепереработке — для производства масел.
· Для изготовления биодизельного топлива — получаемого из растительных масел и используемого для замены обычного дизельного топлива.
· В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей.
· В гражданской обороне для дегазации и нейтрализации отравляющих веществ, в том числе зарина, в ребризерах (изолирующих дыхательных аппаратах (ИДА), для очистки выдыхаемого воздуха от углекислого газа.
· В текстильной промышленности - для мерсеризации хлопка и шерсти.
· Гидроксид натрия также используется для мойки пресс-форм автопокрышек.
· Гидроксид натрия также используется для нелегального производства метамфетаминов и других наркотических средств.
· В приготовлении пищи: для мытья и очистки фруктов и овощей от кожицы, в производстве шоколада и какао, напитков, мороженого, окрашивания карамели, для размягчения маслин и придания им чёрной окраски, при производстве хлебобулочных изделий.
· В косметологии для удаления ороговевших участков кожи, бородавок, папиллом.
2) Тетрахлорид олова, SnCl4 (катализатор) – тяжёлая бесцветная (иногда желтоватая) жидкость, кипит около 114 °C, затвердевает около – 33 °C. На воздухе она дымит.
Получение:
В лабораторных условиях тетрахлорид может быть получен одним из следующих способов:
· прямой синтез:
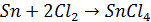
· хлорирование безводного дихлорида олова:
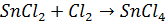
Применение:
· По сведениям ЭСБЕ SnCl4 служит прекрасным растворителем для многих веществ.
· Промежуточный продукт при производстве оловоорганических соединений.
· При производстве мыла, как стабилизатор для ароматизатора и антибактериальное средство.
· Как катализатор при полимеризации стирилена.
· Добавка для упрочнения стекла.
· Для химического лужения
· Для проиведения реакции карометилитоза
· Производство фуксина
· Производство цветных лаков, цветной керамики
· Стабилизатор синтетических смол
· Как катализатор при производстве Фреонов гидрофторированием винилхлорида и винилиденхлорида.
· Добавка при готовке хлебо-булочных изделий
3) Дихлорэтан, C2H4Cl2 (растворитель) – прозрачная бесцветная жидкость с сильным запахом похожим на запах хлороформа, практически не растворимая в воде. Хороший растворитель многих органических соединений и полимеров. Легко испаряется, образует азеотропную смесь с водой. 1,2-дихлорэтан относится к токсичным веществам.
Получение:
Основным методом получения является катализируемая хлоридом железа (III) реакция присоединения хлора к этилену.
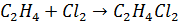
Также применяется метод, основанный на реакции этилена с хлороводородом и кислородом в присутствии катализатора на основе хлорида меди (II):
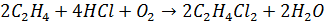
Применение:
Примерно 80 % производимого в мире дихлорэтана используется для получения винилхлорида, важного исходного соединения для синтеза полимерных материалов, в частности — поливинилхлорида:
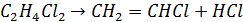
Также используется в органическом синтезе в качестве прекурсора или растворителя для извлечения жиров и алкалоидов, как инсектицид для обеззараживания зерна, зернохранилищ и почвы виноградников. Используют при обработке почвы для борьбы с колорадским жуком и филлоксерой из расчета 1000 кг/га. Применяется моделистами для склейки некоторых пластмасс (например, полистирола).
4) Изопропанол, CH3CH(OH)CH3 – прозрачная, бесцветная жидкость с фруктовым запахом и мягким горьким вкусом.
Получение:
Существует два метода промышленного производства изопропанола:гидрирование ацетона и гидратация пропилена.
Основным способом получения изопропанола в Российской промышленности является сернокислотная гидратация пропилена:
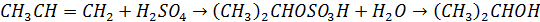
Современный способ – гидрирование ацетона водородом (в фазе пара) в присутствии стационарного медно-никельхромитного катализатора:
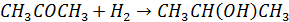
Применение:
Используют для получения:
· ацетона (дегидрированием или неполным окислением)
· пероксида водорода
· метилизобутилкетона
· изопропилацетата
· изопропиламина.
По причине особого государственного регулирования этанола, изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав:
· косметики
· парфюмерии
· бытовой химии
· дезинфицирующих средств
· средства для автомобилей (антифриз, растворитель в зимних стеклоомывателях)
· Репеллентов
· промывок печатных плат после пайки с флюсом, продается под названием «Очиститель универсальный».
Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии. Часто используется при сварке оптических волокон для очистки волокна перед скалыванием.
Метод: