Определите, какой объем займут следующие газы, массы которых известны: 25,0 г тетрафторэтилена; 1,7 г диборана.
Решение
1) 25,0 г тетрафторэтилена.
Вычислим количество газа.
n(C2F4) = m(C2F4) / M(C2F4) = 25,0 / 100,0 = 0,25 моль.
Вычислим объем газа при нормальных условиях, учитывая, что молярный объем газов равен 22,4 л/моль.
V(C2F4) = n(C2F4) · V(C2F4) = 0,25 · 22,4 = 5,6 л.
2) 1,7 г диборана
Вычислим количество газа.
n(B2F6) = m(B2F6) / M(B2F6) = 1,7 / 135,6 = 0,0125 моль.
Вычислим объем газа при нормальных условиях, учитывая, что молярный объем газов равен 22,4 л/моль.
V(B2F6) = n(B2F6) · V(B2F6) = 0,0125 · 22,4 = 0,28 л.
Ответ: V(C2F4) = 5,6 л; V(B2F6) = 0,28 л.
138. Для атома с молярной массой МА и порядковым номером Z: 1) укажите состав атомного ядра, число электронов; 2) составьте электронную формулу атома в стационарном состоянии и возможных возбужденных состояниях: Z = 19; MA = 39.
Решение
Заряд ядра +19, значит, в составе ядра 19 протонов. Вокруг ядра расположены 19 электронов.
Массовое число 39, значит, число нейтронов в ядре 39 – 19 = 20.
Электронная формула атома в основном состоянии:
19K 1s2 2s22p6 3s23p6 4s1
Электронно-графическая формула в основном состоянии:
| s | p | |||
| n=1 | ¯ | |||
| n=2 | ¯ | ¯ | ¯ | ¯ |
| n=3 | ¯ | ¯ | ¯ | ¯ |
| n=4 | |
В возбужденном состоянии атом имеет такое же распределение электронов по квантовым ячейкам.
Один неспаренный электрон, валентность равна 1.
263. Запишите термохимические уравнения взаимодействия веществ A и B с образованием вещества C. Рассчитайте стандартную энтальпию образования C, если известна масса вещества A и тепловой эффект реакции ΔH (кДж). Необходимые для расчета величины возьмите в приложении.
Вещество A — Na2O(к)
m(Na2O) = 10 г
Вещество B — H2O(ж)
Вещество C — NaOH(ж)
DH = –36,6 кДж
Решение
Уравнение реакции:
Na2O(к) + H2O(ж) = 2NaOH(ж); Q = 36,6 кДж.
Молярная масса Na2O равна M(Na2O) = 62,0 г/моль. Вычислим тепловой эффект реакции в расчете на 1 моль Na2O.
DH0 = DH · M(Na2O) / m(Na2O) = –36,6 · 62,0 / 10 = –226,92 кДж/моль.
Термохимическое уравнение:
Na2O(к) + H2O(ж) = 2NaOH(ж); DH0 = –226,92 кДж.
Вычислим DH0(NaOH).
Запишем в соответствии со следствием из закона Гесса:
DH0 = 2DH0(NaOH(ж) – DH0(Na2O(к)) – DH0(H2O(ж))
Отсюда DH0(NaOH(ж)) = 0,5 · (DH0 + DH0(Na2O(к)) – DH0(H2O(ж))
По справочнику:
DH0(Na2O(к)) = –416 кДж/моль
DH0(H2O(ж)) = –285,83 кДж/моль
DH0(NaOH(ж)) = 0,5 · (–226,92 + (–416) –(–285,83)) = –178,5 кДж/моль.
Ответ: DH0(NaOH(ж)) = –178,5 кДж/моль.
363. Константа скорости некоторой реакции при t1=… ºC равна К1, а при t2=… ºC равна К2. Определите энергию активации реакции и рассчитайте К3 при t3= … ºC
t1 = 807ºС
k1 = 1,6
t2 = 27ºС
k2 = 3·10–5
t3 = 427ºС
Решение
Энергия активации Ea связана с константами скорости реакции k при двух температурах T:

k – константы скорости при разных температурах Т.
T1 = t1 + 273 = 807 + 273 = 1080 К.
T2 = t2 + 273 = 27 + 273 = 300 К.
Рассчитываем энергию активации:
 = 37589 Дж/моль (37,6 кДж/моль).
= 37589 Дж/моль (37,6 кДж/моль).
Найдем константу скорости при 427ºС.
T3 = t3 + 273 = 427 + 273 = 700 К.
ln k3 = ln k1 – E/R(1/T3 – 1/T1) = ln 1,6 – (37589 / 8,314) · (1/700 – 1/1080) = –1,8025.
k3 = e–1,8025 = 0,1649.
Ответ: энергия активации 37,6 кДж/моль; константа скорости при 427ºС равна 0,1649.
463. Рассчитайте нормальную концентрацию вещества в растворе, для приготовления которого m г вещества растворили в V мл воды. Плотность раствора ρ, г/мл известна
Вещество — Li2SO4
m = 10 г
V = 500 мл
r = 1,011 г/мл
Решение
Нормальную концентрацию рассчитаем по формуле:
Cн = 
Плотность раствора не требуется для расчета.
Mэ(Li2SO4) = 109,94 / 2 = 54,97 г/моль.
Cн = 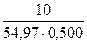 = 0,3638 моль/л.
= 0,3638 моль/л.
Ответ: 0,3638 моль/л.
513. Определите температуру кристаллизации водного раствора данного вещества, если известно, что данный раствор кипит при температуре tºС. Криоскопическая константа воды равна 1,86º, эбуллиоскопическая 0,52º
Вещество — C3H5OH
t = 100,1ºC
Решение
По закону Рауля Dt = K × Cμ, где Dt – понижение температуры замерзания или повышение температуры кипения раствора, К – криоскопическая или эбуллиоскопическая константа, Cμ – моляльность.
Вычислим моляльность:
Cμ = Dt / Kэ = 0,1 / 0,52 = 0,1923 моль/кг.
Зная моляльность, найдем температуру кристаллизации.
Dt = Kк × Cμ = 1,86 · 0,1923 = 0,360.
Температура замерзания равна tз = 0 – 0,36 = –0,36ºС.
Ответ: –0,36ºС.
По приведенным в таблице данным вычислите величину, обозначенную в качестве вопроса.
pH = 11, Ca(OH)2 (насыщ. р-р)
С(Сa2+), моль/л –?
Решение
Схема диссоциации:
Ca(OH)2 ® Ca2+ + 2OH–
Зная pH, вычисляем pOH.
pOH = 14 – 11 = 3.
Тогда [OH–] = 10–3 моль/л.
По уравнению диссоциации видим, что концентрация ионов кальция в 2 раза меньше.
[Ca2+] = 10–3 / 2 = 5·10–4 моль/л.
Ответ: 5·10–4 моль/л.
Для следующих реакций укажите окислитель и восстановитель. Пользуясь методом электронного баланса, расставьте коэффициенты в уравнениях окислительно-восстановительных реакций.
а) HNO2 ® HNO3 + NO + H2O
b) KMnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O
Решение
а) HNO2 ® HNO3 + NO + H2O
Запишем электронно-ионные уравнения.
2| NO2– + 2H+ + e– ® NO + H2O
1| NO2– + H2O – 2e– ® NO3– + 2H+
--------------------------------------------
3NO2– + 4H+ + H2O ® 2NO + 2H2O + NO3– + 2H+
3NO2– + 2H+ ® 2NO + H2O + NO3–
Молекулярное уравнение:
3HNO2 = HNO3 + 2NO + H2O
Окислитель и восстановитель – HNO2, реакция диспропорционирования.
b) KMnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O
Запишем электронно-ионные уравнения.
2| MnO4– + 8H+ + 5e– ® Mn2+ + 4H2O
5| S2– – 2e– ® S
------------------------------------------------
2MnO4– + 16H+ + 5S2– ® 2Mn2+ + 8H2O + 5S
Молекулярное уравнение:
2KMnO4 + 5H2S + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 5S
Окислитель — KMnO4. Восстановитель — H2S.
Составьте схему гальванического элемента, в котором протекает указанная реакция. Напишите уравнения реакций, протекающих на электродах. Рассчитайте ЭДС при стандартных условиях двумя способами. Значения стандартных электродных потенциалов и энергий Гиббса приведены в приложении.
Mn0 + Zn2+ ® Zn0 + Mn2+
Решение
Запишем величины стандартных окислительно-восстановительных потенциалов.
E0(Mn2+/Mn) = –1,18 В
E0(Zn2+/Zn) = –0,763 В
Марганец — более активный металл, будет являться анодом. Цинк — катод.
Анодный процесс: Mn0 – 2e– ® Mn2+
Катодный процесс: Zn2+ + 2e– ® Zn0
Схема элемента:
(–) Mn | Mn2+ || Zn2+ | Zn (+)
Вычисляем ЭДС.
ЭДС = E0(Zn2+/Zn) – E0(Mn2+/Mn) = –0,763 – (–1,18) = 0,417 В.
Вычисляем ЭДС с помощью DG0 ионов:
DG0 = DG0(Mn2+) – DG0(Zn2+) = –229,91 – (–147,16) = –82,75 кДж.
ЭДС = –DG0 / nF
n – число электронов;
F – постоянная Фарадея, 96485 Кл/моль
ЭДС = 82750 / (2 · 96485) = 0,429 В.
Ответ: 0,417 В; 0,429 В.
808. Для данного электролита напишите уравнения процессов, которые идут на электродах при электролизе; рассчитайте, сколько и каких веществ выделится на катоде и аноде, если электролиз вести при силе тока, равной I А, в течении времени t, при выходе по току Вт = %. Значения стандартных электродных потенциалов приведены в приложении.