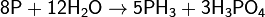Фосфор, получение фосфора, соединения фосфора их св-ва и применение.
Фосфор — химический p-элемент VA- подгруппы третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Один из распространённых элементов земной коры. В свободном состоянии не встречается из-за высокой химической активности. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
15P… 3s2 3p3
Степени окисления: 5, 3, 1, 0, −1, −3
Получение
1) Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
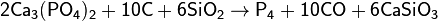
Образующиеся пары фосфора конденсируются в приёмнике под водой в аллотропическую модификацию в виде белого фосфора.
2)Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
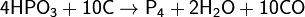
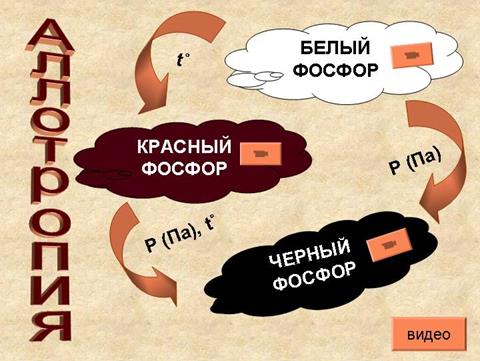
Фосфор образует несколько аллотропических модификаций, из них важнейшие: белый, красный и чёрный.
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией).
Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей). Летальная доза белого фосфора для взрослого человека составляет 0,05—0,1 г.
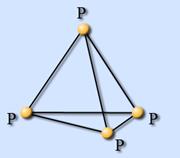
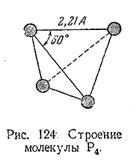 Малая прочность связей между атомами обусловливает высокую химическую активность белого фосфора.
Малая прочность связей между атомами обусловливает высокую химическую активность белого фосфора.
Красный фосфор
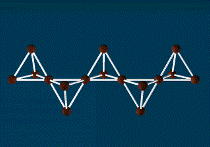
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков).
Чёрный фосфор
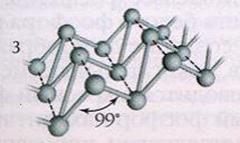
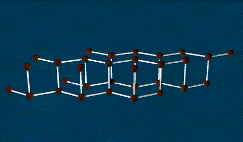
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника.
Взаимодействие с простыми веществами
1) Фосфор легко окисляется кислородом:
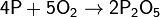 (с избытком кислорода)
(с избытком кислорода)
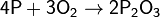 (при медленном окислении или при недостатке кислорода)
(при медленном окислении или при недостатке кислорода)
2) Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
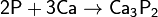
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитеь:
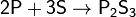
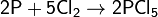
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты: