У Т В Е Р Ж Д А Ю
Первый проректор СПГГИ (ТУ)
Профессор
____________ Н.В. ПАШКЕВИЧ
" ____ " __________ 2001 г.
ТЕСТЫК ЭКЗАМЕНУ
по учебной дисциплине
" Физическая химия "
Наименование учебной дисциплины
для студентов специальности 330200
Шифр специальности
Инженерная защита окружающей среды
Наименование специальности
направления 656600 – Защита окружающей среды
Шифр, наименование
| Начала термодинамики | |
| 1. Функцией состояния системы не является: | 1. Работа 2. Теплоемкость 3. Энтальпия 4. Внутренняя энергия 5. Поверхностное натяжение |
| 2. От пути процесса зависит: | 1. Внутренняя энергия 2. Энергия Гиббса 3. Энергия Гельмгольца 4. Энтропия 5. Тепловой эффект |
| 3. Энтальпия это: | 1. U + pV 2. U – TS 3. H – TS 4. U – pV 5. cp×DT |
| 4. Первое начало термодинамики выражает формула: | 1. dS = dQ/T 2. dU = dQ + dW 3. dG = dH - T×dS 4. dH = dU + p×dV 5. W = - p×DV |
| 5. Тепловой эффект изобарного процесса равен: | 1. Изменению энергии Гиббса системы 2. Энтальпии системы 3. Изменению внутренней энергии системы 4. Изменению энтальпии системы 5. Теплоемкости системы |
| 6. Изохорный процесс протекает: | 1. При постоянной температуре 2. При постоянном объеме 3. При постоянном давлении 4. При постоянной теплоемкости 5. Без теплового эффекта |
| 7. Изобарная теплоемкость аргона равна: | 1. 1,5 R 2. 26 Дж/моль×К 3. 2,5 R 4. 3 R 5. 0,5 RT |
| 8. Для расчета теплоемкости твердых тел используют: | 1. Функции Дебая 2. Функции Эйнштейна 3. Коэффициенты Темкина и Шварцмана 4. Формулу Кирхгофа 5. Уравнение Майера |
| 9. Изобарная теплоемкость при 298 К равна 26 Дж/моль×К у данного вещества: | 1. CaO 2. MgCO3 3. B 4. Si 5. Ca |
| 10. Тепловой эффект реакции равен: | 1. Разности энтальпий образования исходных и конечных веществ 2. Разности энтальпий сгорания конечных и исходных веществ 3. Разности энтальпий растворения исходных и конечных веществ 4. Сумме энергии кристаллической решетки и энтальпии растворения 5. Сумме энтальпии растворения и энергии гидратации ионов |
| 11. Энтропия равна: | 1. pDV 2. U + pV 3. U – pV 4. Qравн/T 5. cp×DT |
| 12. Энтропия равна нулю при | 1. 0 К (идеальный кристалл) 2. 298 К 3. 1 атм 4. постоянном давлении 5. плавлении |
| 13. Энтропия возрастает в процессе | 1. сжатия газа 2. повышения давления 3. повышения температуры 4. кристаллизации 5. конденсации |
| 14. Изменение энтропии при смешивании двух газов выражает формула: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 15. Изменение энергии Гиббса в процессе равно: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 16. В изобарно-изотермических условиях реакции протекают самопроизвольно в направлении: | 1. прямой реакции 2. понижения энергии Гиббса 3. понижения энергии Гельмгольца 4. обратной реакции 5. экзотермической реакции |
| Химическое и фазовое равновесие | |
| 17. Химический потенциал это: | 1. парциальная молярная энергия Гиббса 2. парциальная молярная энтальпия 3. изобарно-изохорный потенциал системы 4. производная внутренней энергии по числу молей 5. изменение потенциальной энергии в ходе реакции |
| 18. Химический потенциал компонента идеального раствора равен: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 19. Константа равновесия не зависит: | 1. от температуры 2. от концентрации 3. от природы реагентов 4. от агрегатного состояния веществ 5. от изменения энергии Гиббса |
| 20. Константа равновесия реакции: Fe3O4 + CO Û 3FeO + CO2 равна | 1.  2.
2.  3.
3.  4.
4.  5.
5. 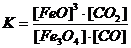
|
| 21. В результате разбавления газовой реакционной смеси инертным газом равновесие смещается в сторону: | 1. реакции с уменьшением объема 2. прямой реакции 3. реакции с увеличением газовых молей 4. экзотермической реакции 5. обратной реакции |
| 22. Давление пара в процессе сублимации чистого вещества вычисляют по формуле: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 23. Температура плавления чистого вещества тем сильнее зависит от давления, чем | 1. меньше энтальпия плавления 2. выше температура плавления 3. больше изменение молярного объема при плавлении 4. больше энтропия плавления 5. меньше энтропия плавления |
| 24. Давление паров воды над разбавленным раствором электролита равно: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 25. Растворимость азота в расплавленном металле равна: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 26. По температуре замерзания раствора нельзя определить: | 1. теплоту плавления растворителя 2. степень диссоциации электролита 3. концентрацию раствора 4. молярную массу растворителя 5. теплоту плавления растворенного вещества |
| 27. Эбуллиоскопическая постоянная равна: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 28. Осмотическое давление раствора равно: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 29. Число компонентов системы равно: | 1. числу термодинамических степеней свободы минус число фаз 2. числу веществ, составляющих систему 3. числу составляющих веществ минус число уравнений связи между их концентрациями 4. числу составляющих веществ, умноженному на степень их диссоциации 5. числу фаз в системе плюс 2 |
| 30. Число компонентов в системе NaNO3 – CaCl2 – H2O равно: | 1. 3 2. 4 3. 2,5 4. 5 5. 2 |
| 31. Инконгруэнтно плавящимся называют соединение | 1. плавящееся без разложения 2. плавящееся при температуре ниже эвтектики 3. разлагающееся по перитектической реакции 4. плавящееся экзотермически 5. плавящееся при температуре выше ликвидуса |
| 32. Температурная остановка на кривой охлаждения сплавов тройной системы соответствует: | 1. ликвидусу 2. двойной эвтектике 3. тройной эвтектике 4. солидусу 5. образованию твердого раствора |
| 33. Линия ликвидуса на фазовой диаграмме двойной системы | 1. выпуклая 2. вогнутая 3. горизонтальная 4. вертикальная 5. прерывистая |
| 34. Число степеней свободы двойной эвтектики в 4-компонентной системе равно: | 1. 0 2. 1 3. 2 4. 3 5. 4 |
| 35. Причиной понижения температуры плавления льда с ростом давления является: | 1. эндотермическое плавление 2. подавление сублимации 3. уменьшение объема при плавлении 4. образование водородных связей 5. сжатие льда |
| Химическая кинетика | |
| 36. Порядок реакции равен: | 1. числу исходных реагентов 2. сумме стехиометрических коэффициентов исходных веществ 3. произведению стехиометрических коэффициентов исходных веществ 4. произведению показателей степени при концентрациях в главном кинетическом уравнении 5. сумме показателей степени при концентрациях в главном кинетическом уравнении |
| 37. Константа скорости реакции зависит: | 1. от концентраций реагентов 2. от парциальных давлений реагентов 3. от времени 4. от температуры 5. от количеств реагентов |
| 38. Зависимость концентрации от времени в реакции первого порядка описывается уравнением: | 1.   2.
2.  3.
3.  4.
4. 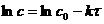 5.
5. 
|
| 39. Период полупревращения в реакции второго порядка равен: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 40. Реакции третьего порядка соответствует линейная зависимость в координатах: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 41. Энергия активации это: | 1. минимальный уровень энергии молекул, необходимый для протекания акта реакции при их столкновении 2. средняя энергия молекул при данной температуре 3. внутренняя энергия активированного комплекса 4. энтальпия переходного состояния реагентов 5. тепловой эффект лимитирующей стадии реакции |
| 42. Энергию активации определяют по угловому коэффициенту прямой в координатах: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 43. Энтропия активации равна нулю в реакции: | 1. обмена 2. первого порядка 3. второго порядка 4. третьего порядка 5. замещения |
| 44. Энтальпия активации равна: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 45. Время жизни активированного комплекса равно: | 1. периоду полупревращения
2.  3.
3.  4. времени установления равновесия
5. несколько секунд
4. времени установления равновесия
5. несколько секунд
|
| 46. Ингибиторы это: | 1. катализаторы биохимических реакций 2. ускорители реакций 3. замедлители реакций 4. положительные катализаторы 5. катализаторы обратной реакции |
| 47. Действие катализаторов основано | 1. на смещении равновесия в сторону прямой реакции 2. на повышении энергии молекул реагентов 3. на понижении энергии активации реакции 4. на повышении энтальпии активации 5. на уменьшении числа стадий реакции |
| 48. Активность твердого катализатора повышается | 1. в результате термической обработки 2. при увеличении дефектов поверхности 3. при полировке поверхности 4. за счет укрупнения гранул 5. при окислении поверхности |
| 49. Константа скорости гетерогенной реакции не зависит от: | 1. скорости перемешивания раствора 2. соотношения объема жидкой и массы твердой фаз 3. температуры 4. природы реагентов 5. концентрации раствора |
50. Угловой коэффициент зависимости  ниже при протекании гетерогенной реакции в следующем режиме: ниже при протекании гетерогенной реакции в следующем режиме:
| 1. диффузионном 2. кинетическом 3. диффузионно-кинетическом 4. стационарном 5. равновесном |
| 51. Сопротивление реакции в диффузионно-кинетическом режиме равно: | 1. сумме констант скорости химической реакции и диффузии 2. произведению констант скорости химической реакции и диффузии 3. разности сопротивлений химической реакции и диффузии 4. сумме сопротивлений химической реакции и диффузии 6. Произведению сопротивлений химической реакции и диффузии |
| 52. Зависимость скорости гетерогенной реакции от концентрации в стационарном режиме описывает следующее уравнение формальной кинетики: | 1. реакции нулевого порядка 2. реакции первого порядка 3. реакции второго порядка 4. первое уравнение Фика 5. второе уравнение Фика |
| 53. Коэффициент диффузии возрастает при: | 1. повышении вязкости раствора 2. понижении температуры 3. увеличении заряда диффундирующего иона 4. увеличении кристаллографического радиуса диффундирующего иона 5. увеличении радиуса диффундирующего иона по Стоксу |
| 54. Согласно первому закону Фика, поток стационарной диффузии пропорционален: | 1. концентрации раствора 2. градиенту концентрации 3. производной концентрации по времени 4. второй производной концентрации по координате 5. обратной температуре |
| 55. Процесс кристаллизации соединения из раствора в стационарном режиме описывает уравнение: | 1.  2.
2.  3.
3.  4.
4.  5
5 
|
| 56. Зависимость концентрации от времени в режиме нестационарной диффузии описывает уравнение: | 1.  2.
2.  3.
3. 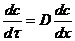 4.
4.  5.
5. 
|
| 57. Расход реагента в режиме нестационарной диффузии пропорционален: | 1. коэффициенту диффузии
2. корню из начальной концентрации
3. корню из времени
4.  5. корню из площади поверхности
5. корню из площади поверхности
|
| Коллоидная химия | |
| 58. Особые свойства дисперсных систем обусловлены: | 1. ненасыщенностью связей в поверхностном слое 2. малой удельной поверхностью 3. агрегатным состоянием дисперсионной среды 4. лиофильностью дисперсной фазы 5. лиофобностью дисперсной фазы |
| 59. Лиофобный коллоид обладает следующим свойством: | 1. дисперсная фаза смачивается жидкой средой 2. образуется самопроизвольно 3. образуется с понижением энергии Гиббса 4. не коагулирует 5. образуется несамопроизвольно |
| 60. Дисперсную систему жидкость – жидкость называют: | 1. золь 2. гель 3. взвесь 4. эмульсия 5. аэрозоль |
| 61. Коллоидные системы имеют размер частиц дисперсной фазы: | 1. меньше 10-9 м 2. больше 10-6 м 3. от 10-3 до 10-5 см 4. меньше 10-7 см 5. от 0,1 до 10-3 мкм |
| 62. Поверхностное натяжение это: | 1. производная энергии Гиббса по диаметру частиц дисперсной фазы 2. работа, затрачиваемая на образование 1 моля дисперсной фазы 3. производная энергии Гиббса по числу молей дисперсной фазы 4. производная энергии Гиббса по площади поверхности раздела фаз 5. Энергия Гиббса, приходящаяся на единицу поверхности раздела фаз |
| 63. Наибольшее поверхностное натяжение имеет следующая жидкость: | 1. вода 2. ацетон 3. бензол 4. ртуть 5. олеум |
| 64. Поверхностное натяжение с ростом температуры | 1. уменьшается 2. увеличивается 3. в изобарных условиях постоянно 4. стремится к бесконечности 5. изменяется немонотонно |
| 65. Интенсивность рассеянного коллоидом света согласно уравнению Рэлея пропорциональна: | 1. оптической плотности раствора
2. длине волны излучения
3. численной концентрации частиц
4.  5. корню из концентрации раствора
5. корню из концентрации раствора
|
| 66. Уравнение седиментационного равновесия лежит в основе определения: | 1. скорости диффузии частиц дисперсной фазы 2. размеров частиц дисперсной фазы 3. поверхности дисперсной фазы 4. скорости оседания дисперсных частиц 5. молярной массы дисперсных частиц |
| 67. Работу когезии необходимо затратить в равновесном изотермическом процессе | 1. отрыва друг от друга твердой и жидкой фаз по площади 1 м2 2. разрыва двух жидких фаз по поверхности раздела единичной площади 3. отрыва 1 моля жидкой фазы от 1 моля твердой фазы 4. разрыва жидкой фазы по сечению площадью 1 м2 5. разрыва двух твердых фаз по поверхности раздела единичной площади |
| 68. Силы поверхностного натяжения направлены | 1. по касательной к поверхности раздела фаз 2. перпендикулярно к поверхности раздела фаз 3. по границе раздела фаз 4. вокруг основания капли 5. не имеют направления |
| 69. При помещении капли жидкости на гидрофобную поверхность | 1. краевой угол больше 900
2. краевой угол меньше 900
3. краевой угол равен нулю
4.  5. краевой угол равен 900
5. краевой угол равен 900
|
| 70. Необходимым условием смачивания является следующее: | 1. работа адгезии меньше работы когезии
2. работа адгезии меньше половины работы когезии
3. работа адгезии больше половины работы когезии
4. отношение работ адгезии и когезии меньше  5. отношение работ адгезии и когезии меньше
5. отношение работ адгезии и когезии меньше 
|
| 71. Краевой угол смачивания водой следующего минерала минимален: | 1. кальцит СаСО3 2. халькопирит CuFeS2 3. кварц SiO2 4. сфалерит ZnS 5. фосфорит Са3(РО4)2 |
| 72. Косинус равновесного краевого угла при измерении считают равным | 1. полусумме косинусов предельных углов оттекания и натекания 2. сумме косинусов предельных углов оттекания и натекания 3. произведению косинусов предельных углов оттекания и натекания 4. отношению косинусов предельных углов оттекания и натекания 5. косинусу разности предельных углов оттекания и натекания |
| 73. Действие пенообразователей основано | 1. на повышении капиллярного давления пузырьков газа 2. на повышении поверхностного натяжения жидкости 3. на повышении избыточной энергии на единице площади поверхности раздела фаз жидкость – газ 4. на понижении поверхностного натяжения жидкости 5. на гидрофилизации поверхности раздела фаз жидкость – газ |
| 74. В капилляре из полиэтилена будет понижаться уровень следующей жидкости: | 1. гептана 2. бензола 3. воды 4. ацетона 5. керосина |
| 75. Давление пара жидкости выше | 1. над выпуклой поверхностью 2. над ровной поверхностью 3. над вогнутой поверхностью 4. над идеальной поверхностью 5. над сферической поверхностью |
| 76. Изотерма адсорбции Гиббса для поверхности раздела фаз жидкость/газ представлена следующим уравнением: | 1.  2.
2.  3.
3.  4.
4.  5.
5. 
|
| 77. Поверхностная активность это | 1.  2. -
2. -  3.
3.  4. -
4. -  5.
5.  
|
| 78. Отрицательную адсорбцию имеют: | 1. неорганические ионы 2. поверхностно-активные вещества 3. мыла 4. пенообразователи 5. масла |
| 79. Предельная адсорбция зависит: | 1. от длины углеводородного радикала 2. от концентрации адсорбата 3. от величины поверхностной активности адсорбата 4. от строения функциональной группы адсорбата 5. от геометрической площади молекулы адсорбата |
| 80. Поверхностная активность однозначно зависит: | 1. от длины углеводородного радикала 2. от концентрации адсорбата 3. от величины предельной адсорбции 4. от дипольного момента молекулы адсорбата 5. от посадочной площадки молекулы адсорбата |
| 81. Константа Лэнгмюра меньше единицы при адсорбции на угле: | 1. бензола 2. катионов металлов 3. мыла 4. масла 5. ацетилацетонатов металлов |
| 82. Физический смысл константы Лэнгмюра в том, что это | 1. константа скорости адсорбции 2. константа скорости десорбции 3. отношение констант скорости десорбции и адсорбции 4. константа адсорбционного равновесия 5. предельная адсорбция |
| 83. Понижение поверхностного натяжения с ростом концентрации ПАВ усиливается | 1. при уменьшении константы Лэнгмюра 2. при понижении температуры 3. при повышении предельной адсорбции 4. с увеличением длины углеводородного радикала 5. с увеличением посадочной площадки молекул ПАВ |
| 84. Потенциалопределяющим ионом на границе раздела фаз сфалерит (ZnS) – раствор является | 1. SO42- 2. Ca2+ 3. Cu2+ 4. Na+ 5. Cl- |
| 85. В слое Штерна на поверхности кальцита СаСО3 из жесткой воды преимущественно адсорбируется: | 1. SO42- 2. Al3+ 3. K+ 4. Cl- 5. HCO3- |
| 86. На поверхности глины из раствора преимущественно адсорбируется: | 1. Al3+ 2. SO42- 3. Na+ 4. Cl- 5. HCO3- |
| 87. Адсорбция катионов Ва2+ на поверхности ангидрита CaSO4 протекает по механизму: | 1. достройки кристаллической решетки 2. образования труднорастворимого поверхностного соединения 3. ионного обмена 4. вторичной адсорбции в слое Штерна 5. вторичной адсорбции в слое Гуи |
| 88. По механизму поверхностной диссоциации протекает образование двойного электрического слоя на поверхности: | 1. шеелита CaWO4 2. кальцита СаСО3 3. апатита Ca5(PO4)3F 4. ангидрита CaSO4 5. сфалерита ZnS |
| 89. Анионит содержит следующую функциональную группу: | 1. сульфогруппу 2. нитрогруппу 3. карбоксильную группу 4. фенольную группу 5. аминогруппу |
| 90. Адсорбция катионов золота Au3+ на анионите возможна, если: | 1. добавить в раствор нитрат натрия 2. добавить в раствор нитрат кальция 3. добавить раствор аммиака 4. добавить соляную кислоту 5. добавить ацетон |
| 91. Удельную поверхность руды можно определить: | 1. по краевому углу смачивания 2. по адсорбции аргона 3. по адсорбции одноименных ионов из раствора 4. по величине поверхностного натяжения 5. по величине электрокинетического потенциала |
| 92. Электрокинетический потенциал уменьшается: | 1. с ростом температуры 2. с ростом ионной силы раствора 3. с ростом концентрации одноименных с минералом ионов в растворе 4. с уменьшением диэлектрической постоянной среды 5. с увеличением скорости потока жидкости |
| 93. Гидраргиллит Al(OH)3 имеет рН изоэлектрической точки 8,1. В нейтральной среде на его поверхности будут преимущественно адсорбироваться ионы: | 1. Са2+ 2. SO42- 3. Na+ 4. Cl- 5. Cu2+ |
| 94. Электроосмос это: | 1. перемещение жидкости относительно дисперсной фазы в электрическом поле 2. перемещение дисперсной фазы в неподвижной среде под действием электрического поля 3. возникновение потенциала при фильтровании раствора 4. возникновение потенциала при оседании частиц дисперсной фазы 5. переход растворителя в раствор через полупроницаемую мембрану |
| 95. В нейтральной жесткой воде к положительному полюсу будут перемещаться частицы: | 1. касситерита SnO2 2. кальцита СаСО3 3. Mg3(PO4)2 4. гидраргиллита Al(OH)3, рНИЭТ=8,1 5. ангидрита CaSO4 |
| 96. Коагуляцию золя глины наиболее эффективно вызывает добавление: | 1. ПАВ 2. сульфата натрия 3. хлорида натрия 4. хлорида алюминия 5. ацетона |
| 97. Коллоидный раствор в отличие от истинного раствора | 1. мутный в проходящем свете 2. опалесцирует в рассеянном свете 3. опалесцирует в проходящем свете 4. содержит частицы крупностью более микрона 5. устойчив во времени |
| 98. Избыток флокулянта повышает устойчивость коллоида вследствие | 1. перезарядки поверхности частиц 2. образования “мостиков” между частицами 3. образования адсорбционно-сольватного барьера 4. сверхэквивалентной адсорбции 5. роста заряда частиц |
| 99. Электрокинетический потенциал это: | 1. потенциал на плоскости скольжения между поверхностным слоем частицы и раствором 2. потенциал на поверхности твердой фазы 3. потенциал на границе слоя Штерна 4. потенциал на границе диффузного слоя 5. потенциал внешней обкладки двойного электрического слоя |
| 100. Седиментационная устойчивость золя обусловлена тем, что | 1. мала скорость диффузии частиц 2. мал электрокинетический потенциал частиц 3. скорость диффузии больше скорости оседания частиц 4. отсутствует двойной электрический слой 5. частицы лиофобны |