Лимфогрануломатоз (болезнь Ходжкина)
Лимфогрануломатоз - это опухолевое заболевание лимфатической системы. Впервые описано Ходжкиным в 1832 году.
Лимфогрануломатоз (ЛГМ) может возникнуть в любом возрасте, однако существует два пика этого заболевания: один в возрасте 20-29 лет(гистологический вариант, главным образом, нодулярный склероз [НС], другой - в возрасте 60 лет и старше(гистологический вариант в большинстве случаев - лимфоидное истончение[ЛИ]). В США более 90% больных ЛГМ - люди белой расы. Заболевание возникает обычно в малочисленных семьях с высоким уровнем жизни и высоким уровнем образования у матери.В России мужчины заболевают несколько чаще. ЛГМ встречается чаще в 3 раза в семьях, где зарегистрированы случаи болезни.
Этиология. Точно неизвестна, однако имеются ассоциации с рядом инфекционных возбудителей и вирусом Эпштейна-Барра. Заболевание сопровождается угнетением клеточного иммунитета. ОсобенностьюЛГМ является обнаружение клеток Рид-Березовского-Штернберга(РБШ), их предшественников, клеток воспаления и клеток, появляющихся в ответ на выделение цитокинов РБШ клетками.
Клетки РБШ - это гигантские клетки с двух и более дольчатым ядром и огромными, эозинофильными, похожими на включение ядрышками. Классические РБШ клетки имеют зеркально симметричные ядра, выглядящие как глаза совы.
Установлены варианты предшественников клеток РБШ. При гистологическом варианте, называемом нодулярным склерозом, встречаются лакунарные клетки - вариант мелких клеток РБШ. Вариант, называемый клетками "воздушной кукурузы", можно встретить при лимфоидном преобладании, а саркоматозный вариант клеток РШБ - при таком гистологическом варианте болезни Ходжкина, как лимфоидное истощение
Экспрессия общего антигена лейкоцитов (LCA или CD45) при большинстве случаев БХ отсутствует, что позволяет отличить ЛГМ от неходжкинской лимфомы (НХЛ).
В редких случаях клетки РБШ можно увидеть при других вариантах рака (например, раке молочной железы, раке легких и меланоме); их также видели при некоторых воспалительных состояниях (например, миозите, инфекционном мононуклеозе). РБШ клетки являются диагностическими при болезни Ходжкина только при наличии соответствующей гистологической структуры.
Патанатомия
Морфологами принято четыре типа гистологических варианта ЛГМ.
1. При лимфогистиоцитоидном (ЛС) варианте пораженная ткань состоит, главным образом, из мелких лимфоцитов и эпителиоидных гистиоцитов. Диагностические клетки РБШ встречаются редко. Преобладает вариант РБШ клеток со складчатыми, скрученными или дольчатыми ядрами, называемых "клетками воздушной кукурузы". Встречаются два подварианта: нодулярный и диффузный. При нодулярном варианте болезни Ходжкина иногда может иметь место прогрессия в лимфоидное истощение или крупноклеточную НХЛ.
2. Нодулярный склероз (НС) -наиболее распространенный гистологический вариант, обычно имеет более хороший прогноз. При окраске гематоксилином и эозином выявляются эозинофильные коллагеновые волокна различной ширины, окруженные голубыми лимфоидными узелками. Некоторые клетки кажутся окруженными прозрачными участками. Они называются лакунарным вариантом РБШ клеток и образуются в результате фиксации клеток. НС делится на две степени - 1 и 11. При II степени встречаются области, обедненные лимфоцитами, или большое число различных по форме гигантских РБШ клеток. Она сопровождается более плохим прогнозом, чем 1 степень.
3. Смешанно-клеточный вариант - 2-й по частоте встречаемости. Характеризуется большим количеством РБШ клеток, окруженных реактивными гистиоцитами, мелкими лимфоцитами и мелкими очагами некроза. Часто встречается фокальное или частичное поражение лимфатических узлов.
4. Лимфоидное истощение, как свидетельствует название, характеризуется снижением числа лимфоцитов и часто - очагами некрозов. Этот вариант может быть связан с синдромом истощающей лихорадки, который наблюдается, главным образом, при поражении тканей ниже диафрагмы и инфильтрации костного мозга
Клиника ЛГМ
Клинические проявления ЛГМ весьма разнообразны. Наиболее частым первым признаком ЛГМ является обнаружение увеличенных лимфоузлов (опорный симптом №1 ФНОО), преимущественно в шейно- наключичной зоне (до 75%).Как правило лимфоузлы при ЛГМ плотноэластичные, безболезненные, неспаянные. У 15-20% больных заболевание начинается с увеличения лимфоузлов средостения, что проявляется кашлем, реже болями за грудиной и синдромом сдавления нижней полой вены.
Значительно реже опухолевый процесс развивается ниже диафрагмы и в частности в забрюшинном пространстве, проявляясь вздутием, болями в животе и пояснице.
В период развернутых проявлений ЛГМ возможно поражение всех лимфоидных органов. Среди других органов может быть поражение легких,костной системы, печени. Возможно поражение ЦНС.Специфических изменений в общем анализе крови не существует, за исключением СОЭ, отражающей активность процесса.

Обнаружение гигантских клеток Рид-Березовского-Штернберга и их одноядерных предшественников, клеток Ходжкина, в биоптате есть обязательный критерий диагноза лимфогранулематоза. По мнению многих авторов, только эти клетки являются опухолевыми. Все остальные клетки и фиброз есть отражение иммунной реакции организма на опухолевый рост. Главными клетками лимфогранулематозной ткани, как правило, будут мелкие, зрелые Т-лимфоциты фенотипа CD2, CD3, CD4 > CD8, CD5 с различным количеством В-лимфоцитов. В той или иной степени присутствуют гистиоциты, эозинофилы, нейтрофилы, плазматические клетки и фиброз. Соответственно различают четыре основных гистологических типа:
· Лимфогистиоцитарный вариант — примерно 15 % случаев лимфомы Ходжкина. Чаще болеют мужчины моложе 35 лет, обнаруживается в ранних стадиях и имеет хороший прогноз. Преобладают зрелые лимфоциты, клетки Рид-Березовского-Штернберга редки. Вариант низкой злокачественности.
· Вариант с нодулярным склерозом — наиболее частая форма, 40—50 % всех случаев. Встречается обычно у молодых женщин, располагается часто в лимфатических узлах средостения и имеет хороший прогноз. Характеризуется фиброзными тяжами, которые делят лимфоидную ткань на «узлы». Имеет две главные черты: клетки Рид-Березовского-Штернберга и лакунарные клетки. Лакунарные клетки большие по размеру, имеют множество ядер или одно многолопастное ядро, цитоплазма их широкая, светлая, пенистая.
· Смешанноклеточный вариант — примерно 30 % случаев лимфомы Ходжкина. Наиболее частый вариант в развивающихся странах, у детей, пожилых людей. Чаще болеют мужчины, клинически соответствует II—III стадии болезни с типичной общей симптоматикой и склонностью к генерализации процесса. Микроскопическая картина отличается большим полиморфизмом со множеством клеток Рид-Березовского-Штернберга, лимфоцитов, плазмоцитов, эозинофилов, фибробластов.
· Вариант с подавлением лимфоидной ткани — самый редкий, меньше 5 % случаев. Клинически соответствует IV стадии болезни. Чаще встречается у пожилых больных. Полное отсутствие лимфоцитов в биоптате, преобладают клетки Рид-Березовского-Штернберга в виде пластов или фиброзные тяжи или их сочетание

1. Микропрепарат: биоптат лимфоузла. Характерная клетка Рид — Березовского — Штернберга
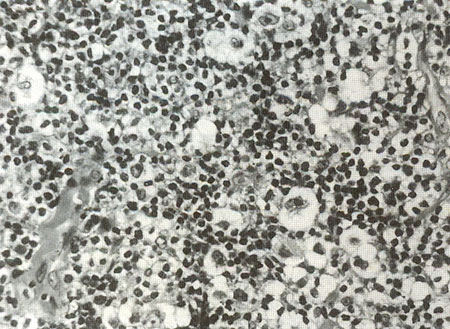
Р.2 Болезнь Ходжкина. Нодулярный склероз. Лакунарные клетки.
Cпособ приготовления цитологического препарата по в.г. воробьеву
Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано для диагностики опухолевых и неопухолевых заболеваний человека. Способ заключается в том, что перед нанесением на подготовленное предметное стекло исследуемый материал помещают в культуральную среду с добавлением антикоагулянта, отмывают oт ненужных примесей путем 3 - 5 мин отстаивания и удаления крупных частиц с последующими разведениями отобранной клеточной взвеси в свежих порциях культуральной среды, готовят несколько проб с заданной концентрацией клеточных элементов и проводят естественную седиментацию клеток на предметное стекло. Полученные таким способом препараты высушивают на воздухе, фиксируют и окрашивают по унифицированной методике. Способ позволяет повысить точность и информативность результатов цитологического исследования за счет повышения качества приготовления цитологических препаратов.
Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано для диагностики опухолевых и неопухолевых заболеваний человека.
При целом ряде заболеваний, особенно онкологических и онкогематологических, прямые цитологические исследования: анализы крови, мочи, спинномозговой, плевральной, синовиальной, асцитической и др. биологических жидкостей, пунктатов костного мозга, лимфатических узлов, внутренних органов, костных и мягкотканных образований - являются основными опорными критериями, вполне достаточными для установления нозологического диагноза. В отдельных случаях цитологическое исследование представляет единственную возможность получить информативную морфологическую картину патологического процесса.
Известны три основных этапа в приготовлении цитологического препарата для световой микроскопии:
процедура предварительной подготовки предметного стекла;
- забор исследуемого материала (пробы) и нанесение его на предметное стекло;
- высушивание, фиксация и окрашивание приготовленного препарата.
Требования к качеству предметных стекол, предназначенных для цитологических препаратов, известны и сводятся к следующим:
- предельная чистота (предметные стекла бракуются, если на них остались следы детергента или другие стойкие налеты, несмотря на тщательную промывку);
-максимальное обезжиривание;
- нейтральная реакция поверхности предметных стекол.
Если качество подготовки предметных стекол легко проверить, то второй этап - непосредственное приготовление препарата - целиком зависит от способа нанесения исследуемого материала на предметное стекло, как то: посредством мазка с помощью шлифованного стеклышка, путем размазывания шпателем по поверхности предметного стекла или методом отпечатка.
За прототип предлагаемого изобретения выбран известный способ приготовления цитологического препарата, включающий нанесение исследуемого материала на подготовленное предметное стекло (см. Справочник "Лабораторные методы исследования в клинике", под ред. проф. В.В.Меньшикова, стр. 99, 101, 111).
Способ осуществляют следующим образом.
На сухое подготовленное предметное стекло, находящееся в горизонтальном положении, мерным капилляром наносят ближе к короткой стороне строго отмеренную каплю исследуемого материала (крови, пунктата или осадка биологической жидкости, полученного центрифугированием) и размазывают ее по стеклу с помощью чистого шлифованного стеклышка, помещая его под углом 45o. Подождав, пока вся капля растечется по короткому ребру стеклышка, быстро проводят им по поверхности предметного стекла. Полученные таким образом мазки высушивают на воздухе, маркируют, фиксируют и окрашивают унифицированными способами.
Однако этот способ приготовления цитологического препарата очень часто не удовлетворяет требованиям качества, в силу того что при световой микроскопии постоянно возникают трудности в морфологической интерпретации клеточных элементов 1) из-за их деформации в толстых участках препарата, где клетки плохо идентифицировать, 2) частичного разрушения, особенно после центрифугирования, механически нестойких форм, а также 3) в связи с меняющимися тинкториальными свойствами самих клеток в зависимости от плотности их микроокружения, pH поверхности предметного стекла и pH среды, в которой клетки находились в естественных условиях, вследствие чего многие из них оказываются перекрашенными. В зависимости от исследуемого материала (пунктаты костных и мягкотканных образований, внутренних органов) от 10 до 25% препаратов содержат только лишь разрушенные клетки, и еще в 10-15% приготовленных образцов обнаруживают значительную примесь крови и разрозненные клетки морфологического субстрата заболевания, по которым бывает трудно судить о характере патологического процесса. В мазках, приготовленных из биологических жидкостей с нормально малым цитозом (ликвор, синовиальная жидкость, моча) посредством нанесения клеточного осадка на предметное стекло, изучение клеточного состава с дифференцированным подсчетом 50-100 клеток для выведения цитограммы оказывается практически нереальным по причине обнаружения в препарате лишь единичных клеточных экземпляров, к тому же не всегда четко прокрашенных, и большого числа разрушенных в результате центрифугирования клеток. Кроме того в разных биологических средах клетки несут различные физико-химические, в частности тинкториальные, характеристики, поэтому нередко в препаратах, приготовленных рутинным способом, часть клеток выглядит как компактные, интенсивно окрашенные структуры, что препятствует их детальному анализу.
В целом, при рутинном способе приготовления цитологических препаратов до 40-50% вынесенных в результате анализа заключений несут противоречивые суждения и не содержат необходимой для эффективной диагностики информации.
Задачей предлагаемого изобретения является повышение точности и информативности результатов цитологического исследования за счет повышения качества приготовления цитологических препаратов.
Поставленная задача решается тем, что в известном способе приготовления цитологического препарата, включающий нанесение исследуемого материала на подготовленное предметное стекло, высушивание на воздухе полученного препарата, его фиксирование и окрашивание по унифицированной методике, отличающийся тем, что предварительно исследуемый материал помещают в культуральную среду с добавлением антикоагулянта отмывают от ненужных примесей путем отстаивания в течение 3 - 5 мин и удаления крупных частиц с последующими разведениями отобранной клеточной взвеси в свежих порциях культуральной среды, готовят пробы с концентрацией ядросодержащих клеточных элементов 100 - 300 тыс./мл, помещают каждую пробу в седиментационную камеру и проводят естественную седиментацию клеток на предметное стекло с установленной постоянной скоростью фильтрации жидкости из камеры, равной 10 мл за 40-60 минут.
В качестве культуральной среды используют любую питательную среду, предназначенную для краткосрочного культивирования клеток: раствор Хенкса, среду 199, среду RPMI-1640 с глутамином и др.
Вид антикоагулянта и его разведение могут быть любые.
Предварительной подготовке по предлагаемому способу подвергаются любые образцы, полученные путем аспирационной пункции (лимфатические узлы, молочные железы, костный мозг в случаях получения скудного содержимого, внутренние органы, полостные и мягкотканные образования), а также биологические жидкости, биоптаты органов и тканей, смывы и соскобы с язвенных поверхностей, незаживающих ран, со слизистых внутренних органов (бронхов, желудка, влагалища), секреты молочных и слюнных желез.
Для спонтанного осаждения клеток на предметное стекло авторы используют седиментационную камеру специальной конструкции, состоящей непосредственно из камеры, в которой размещено предметное стекло, и ввинчивающейся цилиндрической трубки. Схема устройства седиментационной камеры была представлена одним из авторов в методических рекомендациях для врачей "Ранняя диагностика, профилактика и лечение нейролейкемии при лейкозах", авт.: В.Г.Воробьев, С.А.Пугина, В.П.Корбман, А.И.Лебедева. - Горький -1989. Конструкция седиментационной камеры не имеет принципиального значения: для осуществления способа можно использовать любую из действующих модификаций.
Способ осуществляют следующим образом.
Взятый для исследования материал (пунктат, соскоб) помещают в мерную пробирку с 5 мл культуральной жидкости, в которую добавлено 2 капли гепарина в разведении 1:50. Если при пункции получено скудное количество материала, иглу и шприц, которыми производилась манипуляция, промывают заданной культуральной средой, возвращая смыв в исходную пробирку. Содержимое пробирки перемешивают опрокидыванием на пробку, в течение 3-5 минут отстаивают и переливают в другую мерную пробирку таким образом, чтобы более или менее крупные частицы остались на стенках первой пробирки.
Биоптаты органов и тканей или желеобразное содержимое кист или полостей после помещения в пробирку с культуральной средой энергично встряхивают, крупные комочки разбивают с помощью стеклянной палочки, также в течение 3-5 минут отстаивают и переливают в другую мерную пробирку, оставляя крупные частицы ткани в первой пробирке.
Выпоты и другие биологические жидкости (моча, спинномозговая, смывы с пораженных поверхностей), полученные в большом количестве, разливают по 5 мл в исходные центрифужные пробирки с культуральными средами и гепарином. Если доставленный материал содержит много примесей (кристаллы солей, хлопья белка, некротические массы, мелкие тканевые комочки, частицы перевязочного материала), проводят 1- или 2-кратное 3-5 мин отстаивание и перемещение надосадочного слоя в свежие порции культуральной жидкости.
По завершению процедуры отмывания каждую пробу доводят до объема 10 мл добавлением свежего культурального раствора, тщательно перемешивают путем переворачивания пробирки на пробку и в камере Горяева производят подсчет содержания клеток в полученной клеточной взвеси, с тем чтобы определить степень оптимального разведения для приготовления качественных препаратов. Оптимальной концентрацией ядросодержащих клеток для приготовления 1 препарата является 100-300 тыс. в 1 мл. При меньшей концентрации получится малоклеточный цитологический препарат, не удобный для дифференцированного клеточного подсчета. Минимальное количество препаратов, которое можно приготовить из исходной клеточной взвеси, определяется числом, кратным к оптимальной концентрации. Обычно в зависимости от задач, стоящих перед исследователем (напр., постановка цитохимических реакций), из одной матричной пробы готовят от 1-2 до 10-12 препаратов. Если доставленный материал содержит значительную примесь крови, то конечную концентрацию пробы, отобранной для приготовления 1 препарата, рассчитывают, исходя из содержания в ней эритроцитов - не более 2-5 млн. /мл, иначе из-за многослойного наложения эритроцитов друг на друга ядросодержащие элементы в препарате окажутся сдавленными, сморщенными и перекрашенными.
Каждую приготовленную рабочую пробу клеточной взвеси с заданным содержанием клеточных элементов помещают в седиментационную камеру, предназначенную для спонтанного осаждения клеток на предметное стекло при условии медленной элиминации жидкости из системы.
В седиментационный аппарат вставляют подготовленное предметное стекло, которое плотно прижимают к нижней стенке прибора путем ввинчивания сверху цилиндрической трубки с диаметром отверстия 18-20 мм. После плотного прижатия к предметному стеклу цилиндр заполняют рабочей пробой с известной концентрацией ядросодержащих клеток и обратными вращениями ослабляют плотность прижатия цилиндра к предметному стеклу так, чтобы по краям цилиндра стала медленно просачиваться жидкость, которую удаляют фильтровальной бумагой. Задается постоянная скорость фильтрации жидкости из трубки, установленная опытным путем и равная 10 мл за 40 мин - 1 час, благодаря которой клетки равномерно оседают на поверхность предметного стекла и не концентрируются по периметру цилиндра. По окончании процедуры фильтрации предметные стекла извлекают из аппарата, высушивают на воздухе, маркируют, затем фиксируют и окрашивают в соответствии с унифицированной технологией.
Окрашенные препараты после высушивания на воздухе просматривают сначала под малым увеличением микроскопа, оценивают с точки зрения их качества, отмечают характер распределения клеток по препарату, фиксируют клеточные скопления и конгломераты, которые затем анализируют под большим увеличением с иммерсионной системой. Производят дифференцированный подсчет в общей совокупности 100-500 клеток, учитывая изолированно расположенные клетки, доступные идентификации, и монослойные клеточные скопления и комплексы. Ответ выдается в форме цитограммы - дифференцированного распределения клеток в %, описательной характеристики отдельных особенностей клеточных элементов, имеющих диагностическое значение, и, если возможно, цитологического заключения о характере патологического процесса.
К преимуществам метода относятся следующие.
1. Метод дает возможность получать качественные цитологические препараты, в которых достигается однослойное распределение клеток по поверхности стекла, минимальное количество клеточных скоплений и крупных конгломератов (при этом раковые комплексы, если они имеют место, сохраняются несмотря на встряхивание пробирки), отсутствует слизь, кристаллы солей и другие ненужные примеси, мешающие анализу.
2. С помощью данного метода можно добиться оптимальной для микроскопии концентрации клеток на ограниченной площади диаметром 18-20 мм, соответствующей диаметру полого цилиндра в седиментационной камере, и получать хорошую окрашиваемость клеточных структур паноптическими красителями, тем самым повысить достоверность идентификации индивидуальных клеточных элементов.
3. Благодаря процедуре отмывания клеток в культуральных средах, метод позволяет использовать стандартные условия фиксации и окраски всех нативных препаратов, независимо от источника получения материала для цитологического исследования (моча, ликвор, плевральная жидкость, желудочный сок, соскоб со стенок влагалища и т.д.), с хорошим качеством паноптического окрашивания.
4. Рекомендуемый метод обеспечивает проведение дифференцированного подсчета клеток в малоклеточных биологических жидкостях, таких как спинномозговая и синовиальная, которые при нормальной клеточности, если используют общераспространенный способ приготовления цитологических препаратов, оказываются недоступными для цитологического изучения.
5. Метод также обеспечивает приготовление хороших цитологических препаратов из плотной опухолевой ткани и компактной губчатой кости путем приготовления смывов с биоптатов этих тканей, имеет несомненные преимущества перед способом приготовления отпечатков и открывает перспективу изучения цитологии тех опухолевых процессов, которые раньше не могли быть описаны в цитологическом плане по причине трудности получения материала для цитологического исследования.
6. Благодаря устранению этапа центрифугирования клеток, метод существенно снижает влияние технических погрешностей на результат исследования, уменьшает число деформированных и разрушенных клеток в препарате.
7. При пункции костных или синовиальных кистозных образований нередко получают кровь или густую желеобразную массу, которые при приготовлении мазков обычным способом содержат скудное количество клеточных элементов, не позволяющих составить представление о характере патологического процесса. Цитологические препараты, приготовленные в соответствии с предлагаемым способом, обеспечивают возможность изучать клетки, выстилающие то или иное полостное образование.
8. Благодаря предлагаемому методу, врач, производящий манипуляцию, освобождается от процедуры приготовления мазков, требующей специальных навыков.
9. Метод позволяет получить необходимое количество препаратов, предназначенных как для прямого цитологического изучения, так и для постановки дополнительных процедур (цитохимических реакций, анализа хромосом, иммунофенотипирования, культивирования клеток и т.д.).
Улучшение качества получаемых препаратов несомненно повышает точность, достоверность и информативность результатов цитологического исследования.