45. Определения: области молекулярной физики. Системы. Макроскопические параметры системы. Агрегатные состояния и фазы вещества. Способы описания систем в молекулярной физике.
Молекулярная физика – раздел физики, изучающий физические свойства веществ в различных агрегатных состояниях на основе рассмотрения их молекулярного (микроскопического) строения. Молекулярная физика изучает физические свойства макроскопических систем. Предметом её изучения являются молекулярные формы движения больших совокупностей молекул.
Системой называют конечную область пространства с находящимися в ней физическими объектами исследования. Макроскопическими системами называют системы, содержащие большое количество физических объектов. Макроскопические параметры описывают систему как целое. К таким параметрам относятся масса системы, ее температура, объем, давление.
Говоря об агрегатных состояниях вещества, имеют в виду такие характеристики, как наличие или отсутствие собственной формы и собственного объема тела, а также способность к их сохранению. Известны три агрегатных состояния вещества: твердое, жидкое и газообразное.
Фазы или фазовые состояния в термодинамике – термодинамически равновесные (т.е. с постоянными во всех точках системы термодинамическими характеристиками) состояния вещества, различающиеся по физическим свойствам. Газовое, жидкое и кристаллическое состояния (фазы) различаются характером движения структурных единиц (атомов, молекул) и наличием или отсутствием упорядоченной структуры
Физические свойства макроскопических систем, состоящих из большого числа частиц, изучаются двумя взаимно дополняющими методами: статистическим и термодинамическим. Статический метод основан на использовании теории вероятностей и определенных моделей строения изучаемых систем. При термодинамическом методе исследования анализируются условия и количественные соотношения при различных превращениях энергии, происходящих в системе.
46. Основные положения МКТ. Идеальный газ как модель МКТ.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
Основные положения мкт. Согласно мкт любое тело состоит из атомов и молекул; все они находятся в хаотическом движении и взаимодействуют друг с другом.
Наиболее простой моделью является модель идеального газа. Это газ, состоящий из точечных материальных частиц с конечной массой, силами взаимодействия между которыми можно пренебречь, и которые сталкиваются между собой по законам соударения упругих шаров. Следовательно, молекулы идеального газа обладают только кинетической энергией, поскольку потенциальной энергией взаимодействия молекул можно пренебречь. Молекулы движутся непрерывно и беспорядочно, следовательно, в среднем скорости молекул газа в разных направлениях одинаковы. Тот факт, что частицы точечные, позволяет считать, что газ занимает весь предоставленный ему объём, то есть, любая молекула в любой момент времени может находиться в любом месте предоставленного объёма.
47. Изо- процессы. Уравнение состояния идеального газа Клапейрона- Менделеева.
Под термодинамическим процессом понимают всякое изменение состояния системы, характеризующееся изменением ее термодинамических параметров p,V,T. Примеры простейших термодинамических процессов:
 |
1. Изотермический процесс T=const, pV=const.
2. Изобарический процесс p=const, V=C1T.

3. Изохорический процесс V=const, P=C2T.

4. Адиабатический процесс, происходящий без теплообмена между системой и внешней средой.
Уравнение Клапейрона- менделеева: pV / T=B=const. Идеальный газ строго подчиняется данному уравнению, которое, является уравнением состояния идеального газа.
48. Термодинамическое состояние и температура. Принцип детального равновесия. Степени свободы. Закон равнораспределения энергии молекул по степеням свободы.
Термодинамическое состояние- состояние, в котором находится термодинамическая система; Т. с. характеризуется совокупностью макроскопических параметров, определяющих внутренние свойства системы в данном состоянии и её взаимодействие с внешними телами. Параметрами Т. с. являются: температура, давление, объём системы и т. д. Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами (от горячего к холодному). Принцип детального равновесия — общее положение статистики, справедливое для многих случайных процессов и физических систем, находящихся в состоянии термодинамического равновесия. Его суть заключается в равенстве вероятностей прямого и обратного переходов между дискретными состояниями системы. Степени свободы — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных (обобщённых координат), необходимых для полного описания движения механической системы. Равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная  , а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы:
, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы:
 ,где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы: i = iпост. + iвращ. + 2iколеб.
,где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы: i = iпост. + iвращ. + 2iколеб.
49. Основное уравнение МКТ
Основное уравнение мкт идеального газа p=2/3*N/V*m0<v^2>/2=2/3*n<Wk>.
50. Распределение молекул по скоростям Максвелла.
Закон Максвелла о распределении молекул по скоростям. В газе, находящемся в состоянии равновесия, установится некоторое стационарное распределение молекул по скоростям, которое подчиняется статистическому закону. Закон был теоритически выведен Максвеллом в 1859 г. При выводе этого закона Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии теплового движения при одинаковой температуре.
Закон Максвелл а описывается некоторой функцией F(v- скорость), называемой функцией распределения молекул по скоростям: 
51. Барометрическая формула. Распределение Больцмана
Если атмосферное давление на высоте h равно р (рис. 1), то на высоте h+dh оно равно p+dp (при dh>0 dp<0, так как давление с высотой уменьшается). Разность давлений р и p+dp равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью 1 м2:

где ρ — плотность газа на высоте h (dh настолько мало, что при изменении высоты в этом интервале плотность газа можно считать постоянной). Значит,
 (1)
(1)
Зная уравнение состояния идеального газа pV=(m/M) RT (m — масса газа, М — молярная масса газа), находим, что

Подставив это выражение в (1), получим
 или
или 
С изменением высоты от h1 до h2 давление изменяется от р1 до р2 (рис. 67), т. е.

или
 (2)
(2)
Выражение (2) называется барометрической формулой.
Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. 
52. Длина свободного пробега молекул. Явления переноса(диффузия, теплопроводность, вязкость). Броуновское движение.
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторое расстояние λ, которое называется длиной свободного пробега молекул. В кинетической теории вводится понятие средней длины свободного пробега молекул < λ>.  .
.
 Явления переноса. Беспорядочное тепловое движение молекул газа приводят к изменению скоростей и энергий частиц. Если в газе существует пространственная неоднородность плотности, температуры, скорости перемещения отдельных слоев, то происходит самопроизвольное выравнивание этих неоднородностей. В газе возникают потоки вещества, энергии, импульса упорядоченного движения молекул. Эти потоки, характерные для неравновесных состояний газа, являются физический основой особых процессов, объединенных общим названием «явления переноса». К ним относятся диффузия, теплопроводность и внутреннее трение.
Явления переноса. Беспорядочное тепловое движение молекул газа приводят к изменению скоростей и энергий частиц. Если в газе существует пространственная неоднородность плотности, температуры, скорости перемещения отдельных слоев, то происходит самопроизвольное выравнивание этих неоднородностей. В газе возникают потоки вещества, энергии, импульса упорядоченного движения молекул. Эти потоки, характерные для неравновесных состояний газа, являются физический основой особых процессов, объединенных общим названием «явления переноса». К ним относятся диффузия, теплопроводность и внутреннее трение.
 Диффузия - перенос массы с большей плотность к местам с меньшей плотностью.
Диффузия - перенос массы с большей плотность к местам с меньшей плотностью.
Теплопроводность - перенос теплоты от более нагретых мест к менее нагретым местам.
 Внутреннее трение(вязкость)- одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Внутреннее трение(вязкость)- одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Броуновское движение — беспорядочное движение микроскопических видимых, взвешенных в жидкости или газе, частиц твердого вещества, вызываемое тепловым движением частиц жидкости или газа. Броуновское движение никогда не прекращается. Броуновское движение связано с тепловым движением, но не следует смешивать эти понятия. Броуновское движение является следствием и свидетельством существования теплового движения.
53. Термодинамическое описание. 1 начало термодинамики (внутренняя энергия системы, работы по расширению газа, теплота, теплоемкость идеального газа).
Термодинамическая система- макроскопическое тело, находящееся в равновесном состоянии. Состояния любой термодинамической системы могут быть заданы с помощью ряда параметров: P,V,T. Важной характеристикой термодинамической системы является ее внутренняя энергия U- энергия хаотического движения микрочастиц системы и энергия взаимодействия этих частиц. Работа (расширение, сжатие):  ;
;  Энергия механического движения может превращаться в энергию теплового и наоборот. Применительно к термодинамическим процессам эти законом и является первое начало термодинамики. Q=U2-U1+A – первое начало термодинамики (закон сохранения энергии)- теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Для малых процессов: dQ=dU+dA. Удельная теплоёмкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: c=
Энергия механического движения может превращаться в энергию теплового и наоборот. Применительно к термодинамическим процессам эти законом и является первое начало термодинамики. Q=U2-U1+A – первое начало термодинамики (закон сохранения энергии)- теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Для малых процессов: dQ=dU+dA. Удельная теплоёмкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К: c=  Q/mdT.
Q/mdT.
54. Адиабатический процесс. Работа, совершаемая в изо-процессах.
 Изохорический процесс. V=const. Процесс 1-2 соответствует нагреванию, а процесс 2-1- охлаждению газа. При изохорическом процессе газ не совершает работы:
Изохорический процесс. V=const. Процесс 1-2 соответствует нагреванию, а процесс 2-1- охлаждению газа. При изохорическом процессе газ не совершает работы:  A=pdV=0.
A=pdV=0.
 Изобарический процесс. P=const. Он осуществляется при нагревании (процесс 1-2) или охлаждении (процесс 2-1) газа, находящегося в цилиндре с подвижным поршнем, на который действует постоянное внешнее давление.
Изобарический процесс. P=const. Он осуществляется при нагревании (процесс 1-2) или охлаждении (процесс 2-1) газа, находящегося в цилиндре с подвижным поршнем, на который действует постоянное внешнее давление.  A= pdV=P(v2-v1)
A= pdV=P(v2-v1)
Изотермический процесс. T=const.  A=pdV=RTLn v2/v1.
A=pdV=RTLn v2/v1.
 Адиабатический процесс - это процесс, при котором отсутствует теплообмен (
Адиабатический процесс - это процесс, при котором отсутствует теплообмен ( Q=0) между системой и окружающей средой.
Q=0) между системой и окружающей средой.  A= -dU. TV^
A= -dU. TV^ 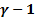 =const или pv^γ=const.
=const или pv^γ=const.
55. Принципы построения тепловых машин. Цикл Карно. КПД цикла Карно
 Обычно в тепловых машинах механическая работа совершается расширяющимся газом. Газ, совершающий работу при расширении, называется рабочим телом. Рабочим телом часто служит воздух или водяные пары. Расширение газа происходит в результате повышения его температуры и давления при нагревании. Устройство, от которого рабочее тело получает количество теплоты Q, называется нагревателем. Для периодической работы тепловой машины необходима еще одна часть машины, называемая холодильником.
Обычно в тепловых машинах механическая работа совершается расширяющимся газом. Газ, совершающий работу при расширении, называется рабочим телом. Рабочим телом часто служит воздух или водяные пары. Расширение газа происходит в результате повышения его температуры и давления при нагревании. Устройство, от которого рабочее тело получает количество теплоты Q, называется нагревателем. Для периодической работы тепловой машины необходима еще одна часть машины, называемая холодильником.
В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. Изотермическое расширение и сжатие заданы кривыми 1-2, 3-4, адиабатическое расширение и сжатие- кривыми 2-3, 4-1. η= = 1+ Q2/Q1= 1- T2/T1- КПД цикла Карно.
56. Обратимые и необратимые процессы. Неравенство Клаузиуса. Энтропия. Закон возрастания энтропии- 2 начало термодинамики.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении и при этом система возвращается в исходное состояние. В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые. Q1/T1 + Q2/T2 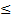 0. Неравенство Клаузиуса:
0. Неравенство Клаузиуса:  Q/T
Q/T 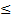 0. Функцию состояния S термодинамической системы называют энтропией: dS=
0. Функцию состояния S термодинамической системы называют энтропией: dS=  Q/T= 0. Второе начало термодинамики в отличие от первого справедливо только по отношению к термодинамическим системам. Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему (Клаузиус). Энтропия изолированной системы не может убывать при любых происходящих в ней процессах, т.е. dS>0.
Q/T= 0. Второе начало термодинамики в отличие от первого справедливо только по отношению к термодинамическим системам. Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему (Клаузиус). Энтропия изолированной системы не может убывать при любых происходящих в ней процессах, т.е. dS>0.