Глава 2. Кинетика восстановления металла из оксидов
Восстановление твердых оксидных фаз относится к топохимическим реакциям, протекающим на межфазной границе восстанавливаемого оксида и его продукта. Скорость химических взаимодействий зависит от состояния и размера поверхности раздела фаз.
Механизм и кинетическая схема восстановления металлов
Из оксидов газами
Общепринятые представления о механизме реакций восстановления металлов из их оксидов обобщены в настоящее время в адсорбционно-каталитической теории, предложенной Чуфаровым Г.И. и развитой в работах Ростовцева С.Т., Есина О.А., Гельда П.В. и других ученых. В основе ее лежит положение о первостепенной роли адсорбции в процессах восстановления.
Согласно данной теории механизм восстановления включает три стадии:
1) адсорбцию восстановителя на реакционной поверхности;
2) кристаллохимический акт, включающий переход кислорода решетки оксида к адсорбированным молекулам восстановителя с одновременной перестройкой решетки исходного оксида в решетку продукта восстановления;
3) десорбцию газообразного продукта восстановления.
Этот механизм представляется схемой:
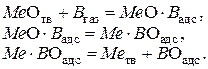
Суммарный процесс соответствует реакции:
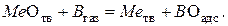
По адсорбционной теории реагируют с оксидами только те молекулы газа-восстановителя, которые адсорбировались на поверхности оксида.
Адсорбция происходит на активных центрах. Идет отрыв атомов (ионов) кислорода от катионов металла, образование адсорбционных комплексов (например, 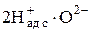 ), из которых формируются молекулы продукта восстановления, десорбирующиеся в газовую фазу.
), из которых формируются молекулы продукта восстановления, десорбирующиеся в газовую фазу.
Потеря кислорода оксидом ведет к образованию пересыщенного твердого раствора низшего оксида в высшем или раствора металла в оксиде при протекании последней ступени восстановления. Такой раствор неустойчив и распадается. Результатом является появление кристаллов новой фазы, которые в дальнейшем растут.
С точки зрения адсорбционно-каталитической теории процесс восстановления является автокаталитическим, т.е. образование твердого продукта реакции приводит к ускорению процесса его образования.
Автокатализ связан с локализацией реакции на границе раздела фаз оксид – твердые продукты восстановления, которая является своеобразным катализатором, возникающим в ходе самого процесса. В условиях, соответствующих кинетическому режиму процесса, как правило, при восстановлении наблюдается характерный для автокатализа максимум скорости на определенном этапе восстановления. Типичные кинетические зависимости изменения скорости процесса 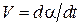 и изменения степени восстановления
и изменения степени восстановления 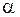 во времени t приведены на рис. 16. Как видно, можно выделить три периода, характерных для топохимических реакций:
во времени t приведены на рис. 16. Как видно, можно выделить три периода, характерных для топохимических реакций:
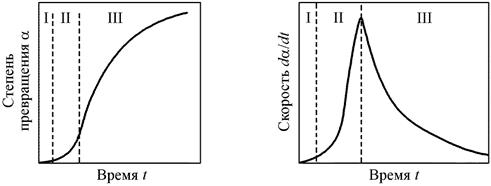
Рис. 16. Кинетика топохимических реакций
I – индукционный период, характеризующийся малыми скоростями процесса, связанными с трудностями зарождения новой фазы;
II – автокатализ, связанный с ускорением реакции из-за постоянно увеличивающейся поверхности раздела двух твердых фаз и деформацией сопрягающихся решеток фаз;
III – период замедления процесса; уменьшение скорости связано с уменьшением количества старой фазы и поверхности раздела.
Следует отметить, что при отсутствии торможений в зарождении новой фазы I и II периоды могут отсутствовать.
С кинетической точки зрения восстановление оксидов газами является сложным гетерогенным процессом, включающим следующие стадии:
1) подвод восстановителя из ядра газового потока к наружной поверхности восстанавливаемого оксида; это этап внешней диффузии, или внешней массопередачи;
2) диффузия восстановителя к реакционной зоне через макро- и микропоры, дефекты решетки слоя твердого продукта восстановления; это этап внутренней диффузии или внутренней массопередачи;
3) собственно химическая реакция восстановления с кристаллохимическим превращением исходного оксида в низший или металл (по адсорбционно-каталитическому механизму);
4) отвод газообразных продуктов восстановления в газовый поток путем внутренней и внешней массопередачи.
Из этой схемы следует, что восстановление является совокупностью двух видов процессов:
– взаимодействия газов с оксидами на реакционной поверхности;
– диффузии газов между ядром потока и реакционной поверхностью.
В зависимости от того, какой из этих процессов протекает наиболее медленно (является лимитирующим), наблюдается:
– либо неодинаковое влияние одних и тех же факторов на скорость восстановления;
– или отсутствие влияние некоторых из них в определенных условиях.
Различное соотношение скоростей диффузии и реакции восстановления приводит к двум типам восстановления: ступенчатому и зональному.
Ступенчатость и зональность являются проявлением справедливости принципа последовательности превращений А. А. Байкова, который для системы Fe–O представляется схемой (при T > 570 °C):
Fe2O3 ® Fe3O4 ® FeO ® Fe.
При ступенчатом типе восстановления наблюдается строгая повременная последовательность в смене отдельных ступеней восстановления во всем объеме куска (зерна) оксида. Это означает: если обеспечить свободную доставку восстановителя в любой участок зерна восстанавливаемого оксида, например, Fe2O3, то все зерно Fe2O3 вначале превратится в Fe3O4, затем в FeO и только после этого появится Fe.
При зональном типе восстановления наблюдается пространственное разделение ступеней восстановления. Это означает: если кусок (зерно) Fe2O3 подвергнуть восстановлению в условиях затрудненной диффузии газов, то в какой-то момент времени частично восстановленный гематит окажется состоящим из зон, соответствующих отдельным ступеням восстановления. При этом на поверхности куска может быть железо, под ним зоны FeO и Fe3O4; внутри сохраняется ядро Fe2O3. Границы зон по ходу восстановления, по мере обеспечения их необходимым количеством восстановителя продвигаются друг за другом к центру куска.
Таким образом:
Ступенчатый тип процесса характерен для кинетического режима и реализуется при измельченном материале, находящемся во взвешенном состоянии в газовом потоке, или при наличии высокопористого оксида.
Зональный характер восстановления наблюдается при восстановлении плотных материалов в условиях диффузионного режима. В реальных условиях идеальное расположение зон может быть нарушено вследствие разного рода макродефектов (трещины, поры и др.), имеющихся в рудных материалах, по которым газ может диффундировать внутрь оксида. При этом получается “размытая” (вплоть до центра зерна) реакционная зона.
Следует иметь в виду, что при сопоставимых скоростях реакции восстановления и диффузии процесс может идти в смешанном (переходном) режиме, или диффузионно-кинетическом режиме. Именно в этом режиме процесс характеризуется наиболее сложными кинетическими закономерностями.
Формально-кинетические закономерности восстановления газами
Количественный анализ кинетических закономерностей топохимических реакций восстановления очень сложен. Теоретическое описание кинетики процесса восстановления для получения математической модели с перспективой внедрения ее в промышленную автоматизации разрабатывалось рядом ученых: Стальхане, Мальмберг, Любан, Манчинский и др. Наиболее полное решение было сделано Ростовцевым С.Т. в виде диффузионно-кинетической теории восстановления. При этом получились очень громоздкие уравнения, требующие для их количественного анализа ряда трудно определяемых из практики процессов параметров.
В данном разделе рассматриваются несколько идеализированных случаев восстановления, позволяющих с определенными приближениями к реальным процессам выяснить влияние ряда факторов на кинетику реакций.
Упражнение 11. На основе общих положений химической кинетики обратимых адсорбционно-химических гетерогенных реакций получить кинетическое уравнение для описания скорости процесса восстановления в кинетическом режиме.
Решение. Если процесс не лимитируется сложной в кинетическом описании кристаллохимической стадией зарождения новой фазы, то обратимую реакцию восстановления можно представить схемой
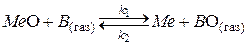
Скорость ее равна: 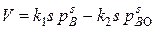 , (44)
, (44)
где 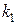 и
и 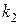 – константы скорости прямой и обратной реакций.
– константы скорости прямой и обратной реакций.
Так как общее давление газа 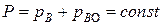 ,
,
то 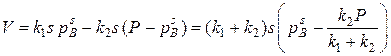
При равновесии 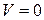 или
или 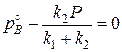
где 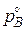 – равновесное давление восстановителя.
– равновесное давление восстановителя.
Обозначив 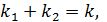 имеем
имеем 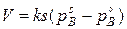 (45)
(45)
Полученное уравнение показывает, что скорость процесса определяется величиной реакционной поверхностью, температурой и давлением газа на реакционной поверхности.
Если диффузия газа к поверхности реакционной не затруднена (кинетический режим), то 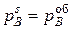 ,где
,где 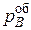 – парциальное давление газа-восстановителя в объеме реактора, и уравнение (45) принимает вид:
– парциальное давление газа-восстановителя в объеме реактора, и уравнение (45) принимает вид:
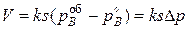 (46)
(46)
Следует отметить, что при более строгом выводе данного уравнения с учетом адсорбционно-десорбционных явлений, получаются более сложные зависимости.
Пример 8. В таблице 12 представлены экспериментальные данные [12] по кинетике восстановления оксида хрома Cr2O3 водородом (α – степень восстановления):
Таблица 12
| Т, К | Время t, час | ||||||
| α,% | 0,055 | 0,12 | 0,236 | 0,306 | 0,437 | ||
| 0,11 | 0,25 | 0,447 | 0,632 | 0,764 | |||
| 0,27 | 0,414 | 0,765 | 0,989 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
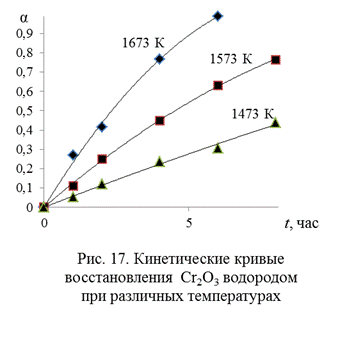 Решение. Представим данные опыта графически (рис. 17). Видно, что в условиях опытов временная зависимость степени превращения имеет монотонный характер, и автокаталитический период отсутствует.
Решение. Представим данные опыта графически (рис. 17). Видно, что в условиях опытов временная зависимость степени превращения имеет монотонный характер, и автокаталитический период отсутствует.
Проверим применимость для описания кинетики процесса уравнения Мак-Кевана
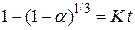 , которое можно представить уравнением
, которое можно представить уравнением 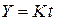 ,
,
где 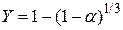
Результаты вычисления функции Y даны в таблице 13.
Таблица 13
| Т, К | t, час | |||||||
| Y | 0,019 | 0,042 | 0,086 | 0,115 | 0,174 | |||
| 0,038 | 0,091 | 0,179 | 0,283 | 0,382 | ||||
| 0,100 | 0,163 | 0,383 | 0,778 |
На рис. 18 представлены значения вычисленной функции Y в зависимости от времени при температурах опытов. Линии проведены с помощью одной из расчетно-графических программ ЭВМ, показаны уравнения линий и коэффициенты корреляции переменных R 2. 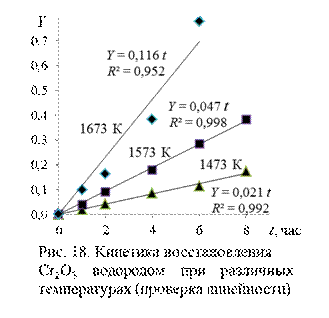
 Видно, что требуемая уравнением Мак-Кевана линейность функции
Видно, что требуемая уравнением Мак-Кевана линейность функции 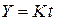 выполняется достаточно удовлетворительно. Можно заключить, что процесс протекает в кинетическом режиме.
выполняется достаточно удовлетворительно. Можно заключить, что процесс протекает в кинетическом режиме.
Проверим применимость для описания кинетики процесса уравнения Яндера
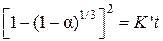 , которое можно представить уравнением
, которое можно представить уравнением 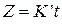 ,
,
где 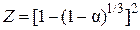
Результаты вычисления функции 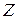 даны в таблице 14.
даны в таблице 14.
Таблица 14
| Т, К | t, час | |||||||
| Z | 0,0003 | 0,0017 | 0,0074 | 0,0131 | 0,0304 | |||
| 0,0015 | 0,0084 | 0,0321 | 0,0803 | 0,1459 | ||||
| 0,0099 | 0,0266 | 0,1466 | 0,6047 |
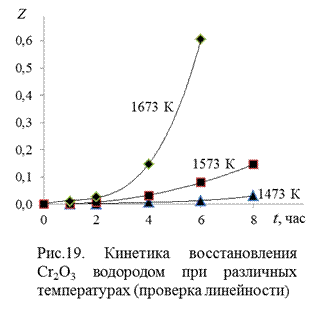
На рис. 19 представлены значения функции Z в зависимости от времени при температурах опытов. Видно, что требуемая уравнением Яндера линейность функции 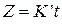 не выполняется. Можно без проверки полагать, что и уравнение Кранка, Гистлинга и Браунштейна
не выполняется. Можно без проверки полагать, что и уравнение Кранка, Гистлинга и Браунштейна 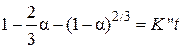 , которое как и уравнение Яндера описывает кинетику процесса в диффузионном режиме, также будет не применимым для представленных опытов.
, которое как и уравнение Яндера описывает кинетику процесса в диффузионном режиме, также будет не применимым для представленных опытов.
Для вычисления энергии активации применим уравнение Аррениуса в виде 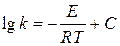 , (64)
, (64)
где E – кажущаяся энергия активации; 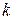 – константа скорости реакции.
– константа скорости реакции.
Уравнение Аррениуса отражает влияние температуры на константу скорости собственно химических реакций. Наблюдаемые зависимости отражают более сложные закономерности. Действительно, влияние температуры должно проявляться не только в изменении константы 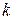 , но и через величину
, но и через величину 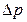 , в которую входит давление газа-восстановителя, близкое к равновесному
, в которую входит давление газа-восстановителя, близкое к равновесному 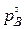 и определяемое величиной константы равновесия реакции, зависящей от температуры, см. уравнение (46). Поэтому уравнение Аррениуса вида
и определяемое величиной константы равновесия реакции, зависящей от температуры, см. уравнение (46). Поэтому уравнение Аррениуса вида 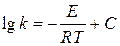 применено к анализу температурной зависимости не константы скорости
применено к анализу температурной зависимости не константы скорости 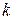 реакции, а суммарной скорости гетерогенного процесса. Входящая в уравнение энергия активации E называется кажущейся.
реакции, а суммарной скорости гетерогенного процесса. Входящая в уравнение энергия активации E называется кажущейся.
Для ее вычисления найденные обобщенные константы скорости процесса восстановления K, входящие в уравнения Мак-Кевана при температурах опытов, представим в таблице 15 в виде 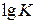 . Затем строим график в координатах
. Затем строим график в координатах 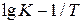 (рис. 20). На графике приведено уравнение прямой линии и коэффициент корреляции переменных.
(рис. 20). На графике приведено уравнение прямой линии и коэффициент корреляции переменных.
Угловой коэффициент полученной линейной зависимости соответствует кажущейся энергии активации 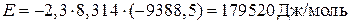 .
.
Такое высокое значение энергии активации характерно для гетерогенных процессов, протекающих в кинетическом режиме.
 Рис. 19. Температурная зависимость
константы скорости процесса
восстановления Cr2O3 водородом
Рис. 19. Температурная зависимость
константы скорости процесса
восстановления Cr2O3 водородом
| Таблица 15 | ||
| Константы уравнения Мак-Кевана | |||
| T, K | K | 1/ T | lg K |
| 0,021 | 0,000679 | -1,6990 | |
| 0,047 | 0,000636 | -1,3279 | |
| 0,116 | 0,000598 | -0,9355 | |
Пример 9. В таблице 16 представлены экспериментальные данные [13] по кинетике восстановления оксида никеля NiO водородом (α – степень восстановления):
Таблица 16
| 484 К | t, мин | ||||||||||||||
| α, | 0,013 | 0,033 | 0,086 | 0,138 | 0,197 | 0,25 | 0,309 | 0,349 | 0,388 | 0,428 | 0,461 | 0,553 | 0,618 | 0,645 | |
| 502 К | t, мин | 5,5 | |||||||||||||
| α, | 0,033 | 0,138 | 0,257 | 0,388 | 0,474 | 0,546 | 0,592 | 0,625 | 0,658 | 0,674 | 0,691 | 0,711 | 0,724 |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
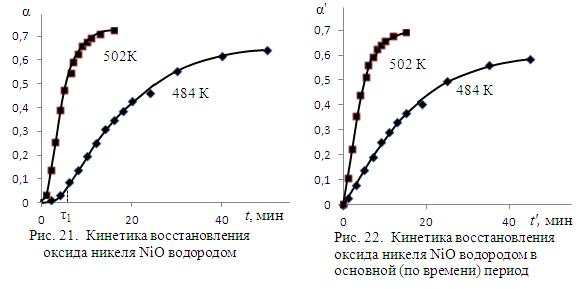
Решение. Представим данные опыта графически (рис. 21). Видно, что в условиях опытов в начальный период проявляется увеличение скорости процесса, что можно объяснить явлениями автокатализа. Этот временной период достаточно мал и его можно исключить из анализа макрокинетики процесса. Иначе, проверку применимости упрощенных кинетических уравнений к описанию кинетики данного процесса можно выполнить, пренебрегая небольшим количеством восстановленного оксида за время до максимума скорости. На кривой α – t максимум скорости соответствует точке ее перегиба (τ при 484 К на рисунке 21). Тогда начальные условия процесса смещаются: время t = τ и α = αmax оказываются исходными для анализа кинетических зависимостей. Эти величины могут быть приняты равными: для Т 1=484 К – 5 мин и 0,055; для Т 2=502 К – 1 мин и 0,033.
С учетом вышеизложенного данные для анализа кинетики процесса преобразуются в величины, представленные в таблице 17 и на рис. 22.
Таблица 17
| 484 К | t’, мин | |||||||||||||
| α’ | 0,031 | 0,083 | 0,142 | 0,195 | 0,254 | 0,294 | 0,333 | 0,373 | 0,406 | 0,498 | 0,563 | 0,59 | ||
| 502 К | t,’, мин | 5,5 | ||||||||||||
| α’ | 0,105 | 0,224 | 0,355 | 0,441 | 0,513 | 0,559 | 0,592 | 0,625 | 0,641 | 0,658 | 0,678 | 0,691 |
Проверим применимость для описания кинетики процесса уравнений Мак-Кевана 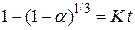 и Яндера
и Яндера 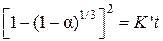 , которые можно представить выражениями
, которые можно представить выражениями 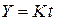 и
и 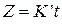 , где
, где 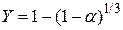 и
и 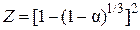
Результаты вычисления функции Y даны в таблице 18.
Таблица 18
| 484 К | t’, мин | |||||||||||||
| Y | 0,000 | 0,010 | 0,028 | 0,050 | 0,070 | 0,093 | 0,110 | 0,126 | 0,144 | 0,159 | 0,205 | 0,241 | 0,257 | |
| Z | 0,0000 | 0,0001 | 0,0008 | 0,0025 | 0,0049 | 0,0087 | 0,0120 | 0,0159 | 0,0208 | 0,0254 | 0,0421 | 0,0581 | 0,0661 | |
| 502 К | t’, мин | 5,5 | ||||||||||||
| Y | 0,000 | 0,036 | 0,081 | 0,136 | 0,176 | 0,213 | 0,239 | 0,258 | 0,279 | 0,289 | 0,301 | 0,315 | 0,324 | |
| Z | 0,000 | 0,001 | 0,007 | 0,018 | 0,031 | 0,045 | 0,057 | 0,067 | 0,078 | 0,084 | 0,090 | 0,099 | 0,105 |
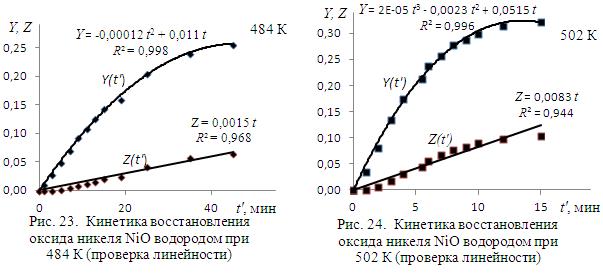
На рис. 23 и 24 представлены значения вычисленных функций Y и Z в зависимости от времени при температурах опытов. Линии проведены с помощью одной из расчетно-графических программ ЭВМ, показаны уравнения линий и коэффициенты корреляции переменных R 2. Видно, что требуемая уравнением Мак-Кевана линейность функции 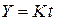 не выполняется, тогда как требуемая уравнением Яндера степенная зависимость обнаруживается с достаточно высокой достоверностью.. Можно заключить, что процесс в анализируемый временной период протекает в диффузионном режиме.
не выполняется, тогда как требуемая уравнением Яндера степенная зависимость обнаруживается с достаточно высокой достоверностью.. Можно заключить, что процесс в анализируемый временной период протекает в диффузионном режиме.
Кажущуюся энергию активации E находим, применив уравнение Аррениуса в форме 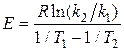 , где
, где 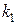 и
и 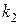 – константы пропорциональности в зависимостях
– константы пропорциональности в зависимостях 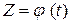 при температурах T 1 и T 2. Вычисленное значение энергии активации процесса равно 192 кДж/моль и указывает на существенные диффузионные затруднения процесса при относительно невысоких температурах опытов.
при температурах T 1 и T 2. Вычисленное значение энергии активации процесса равно 192 кДж/моль и указывает на существенные диффузионные затруднения процесса при относительно невысоких температурах опытов.
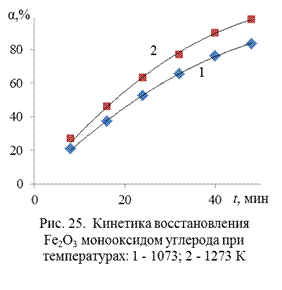
Пример 10. В таблице 17 представлены экспериментальные данные [15] по кинетике восстановления оксида Fe2O3 монооксидом углерода (α – степень восстановления):
Таблица 17
| 1073 К | t, мин | ||||||
| α | 20,8 | 37,1 | 52,5 | 65,6 | 76,2 | 83,4 | |
| 1273 К | t, мин | ||||||
| α |
Представить данные графически. Проверить применимость к описанию кинетики данного процесса простых формально-кинетических уравнений связи степени превращения со временем. Сделать вывод о режиме протекания процесса. Вычислить энергию активации процесса.
Решение. Представим данные опыта графически (рис. 25). Видно, что в условиях опытов временная зависимость степени превращения имеет монотонный характер, и автокаталитический период отсутствует.
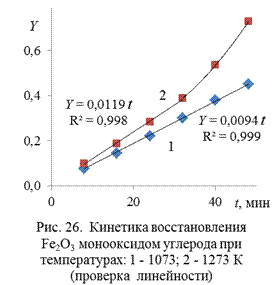
Проверим применимость для описания кинетики процесса уравнения Мак-Кевана 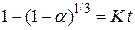 , которое можно представить уравнением
, которое можно представить уравнением 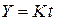 , где
, где 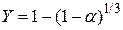 . Результаты вычисления функции Y даны в таблице 13.
. Результаты вычисления функции Y даны в таблице 13.
Таблица 18
| Т, К | t, мин | |||||||
| Y | 0,075 | 0,143 | 0,220 | 0,299 | 0,380 | 0,450 | ||
| 0,100 | 0,186 | 0,282 | 0,387 | 0,536 | 0,729 |
На рис. 26 представлены значения вычисленной функции Y в зависимости от времени при температурах опытов. Видно, что требуемая уравнением Мак-Кевана линейность функции 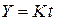 выполняется для опыта при температуре 1073 К во всем временном интервале, а для опыта при 1273 К только в первой временной половине процесса. Результаты обработки данных только четырех измерений опыта при 1273 К показаны на рис. 26, где представлены уравнение прямой и коэффициент корреляции переменных R 2 =0,998. Можно заключить, что в условиях выполнения линейности процесс протекает в кинетическом режиме. Для опыта при температуре 1273 К, где линейность функции
выполняется для опыта при температуре 1073 К во всем временном интервале, а для опыта при 1273 К только в первой временной половине процесса. Результаты обработки данных только четырех измерений опыта при 1273 К показаны на рис. 26, где представлены уравнение прямой и коэффициент корреляции переменных R 2 =0,998. Можно заключить, что в условиях выполнения линейности процесс протекает в кинетическом режиме. Для опыта при температуре 1273 К, где линейность функции 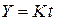 не выполняется, можно предположить, что процесс протекает в диффузионном режиме. Проверим в этом случае применимость для описания кинетики уравнения Яндера и уравнения Кранка, Гистлинга и Браунштейна. Первое из них запишем как
не выполняется, можно предположить, что процесс протекает в диффузионном режиме. Проверим в этом случае применимость для описания кинетики уравнения Яндера и уравнения Кранка, Гистлинга и Браунштейна. Первое из них запишем как 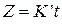 , где
, где 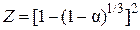 , а второе в виде
, а второе в виде 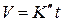 , где
, где 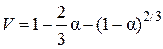 .
.
Результаты вычисления функций 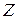 и V даны в таблице 19, а временные зависимости их представлены на рис. 27 и 28. Отсутствие линейности функций в вышеуказанных временных интервалах вновь указывает на верность вывода о кинетическом режиме процесса в данных условиях.
и V даны в таблице 19, а временные зависимости их представлены на рис. 27 и 28. Отсутствие линейности функций в вышеуказанных временных интервалах вновь указывает на верность вывода о кинетическом режиме процесса в данных условиях.
Таблица 19
| Т, К | t, мин | |||||||
| Z | 0,0056 | 0,0205 | 0,0483 | 0,0896 | 0,1446 | 0,2029 | ||
| 0,0053 | 0,0185 | 0,0412 | 0,0717 | 0,1080 | 0,1420 | |||
| V | 0,0099 | 0,0345 | 0,0796 | 0,1500 | 0,2871 | 0,5308 | ||
| 0,0093 | 0,0302 | 0,0646 | 0,1113 | 0,1846 | 0,2730 |
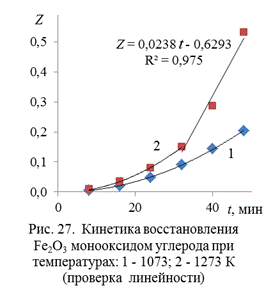
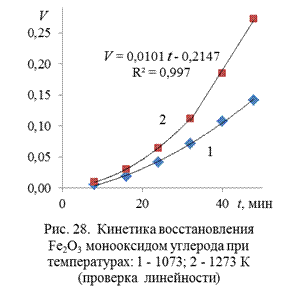
На заключительном этапе процесс при 1273 К переходит в диффузионный режим. Этот вывод подтверждают линейные зависимости функций Z и V от времени, начиная с 32-ой минуты. При этом уравнение Кранка, Гистлинга и Браунштейна с большей достоверностью описывает кинетику процесса (коэффициент корреляции равен 0,997), чем уравнение Яндера.
Кажущуюся энергию активации E находим, применив уравнение Аррениуса в форме 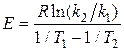 , где
, где 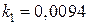 и
и 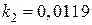 – константы пропорциональности в зависимостях
– константы пропорциональности в зависимостях 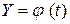 при температурах T 1 = 1073 К и T 2 = 1273 К. Вычисленное значение энергии активации процесса равно 13,4 кДж/моль.
при температурах T 1 = 1073 К и T 2 = 1273 К. Вычисленное значение энергии активации процесса равно 13,4 кДж/моль.