Модель Томсона. Атом представляет собой непрерывно заряженный положительным зарядом шар с линейными размерами порядка 10-10м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом нейтрален.Эта модель после опытов Резерфорда по рассеянию α-частиц в веществе была отвергнута.
 Модель атома Резерфорда. Вокруг положи-тельного ядра с зарядом Ze, размером 10-15—10-14 м и массой, практически равной массе атома, в области с линейными размерами ~10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома.Атомы нейтральны, поэтому заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра вращается Z электронов (Z — порядковый номер элемента в системе Менделеева).На основании второго закона Ньютона для электрона, движущегося по окружности под действием кулоновской силы,
Модель атома Резерфорда. Вокруг положи-тельного ядра с зарядом Ze, размером 10-15—10-14 м и массой, практически равной массе атома, в области с линейными размерами ~10-10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома.Атомы нейтральны, поэтому заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра вращается Z электронов (Z — порядковый номер элемента в системе Менделеева).На основании второго закона Ньютона для электрона, движущегося по окружности под действием кулоновской силы,
Это условие содержит два неизвестных: r и v, т. е. величины r и v (а значит, и энергия) могут изменяться непрерывно, т. е. спектры атомов — сплошные. Однако атомы имеют линейчатые спектры. Поэтому модель атома Резерфорда противоречила опытным данным.  Линейчатый спектр атомов
Линейчатый спектр атомов
Каждому газу присущ свой линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий.
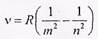 Обобщенная формула Бальмера
Обобщенная формула Бальмера
 описывает серии в спектре простейшего атома — атома водорода. ν — частота спектральных линий в спектре атома водорода; R - постоянная Ридберга; m определяет серию (m = 1,2,3,...); n определяет отдельные линии соответствую-щей серии (n = m + 1, m + 2,...)
описывает серии в спектре простейшего атома — атома водорода. ν — частота спектральных линий в спектре атома водорода; R - постоянная Ридберга; m определяет серию (m = 1,2,3,...); n определяет отдельные линии соответствую-щей серии (n = m + 1, m + 2,...)
Спектральные серии атома водорода
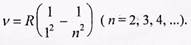 В ультрафиолетовой области спектра
В ультрафиолетовой области спектра
серия Лаймана
 В видимой области спектра
В видимой области спектра
серия Бальмера
В инфракрасной области спектра
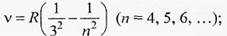 серия Пашена
серия Пашена
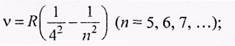
серия Брэкета

серия Пфунда
 серия Хэмфри
серия Хэмфри
Эти формулы подобраны эмпирически, подтверждены экспериментально, но не имели теоретического обоснования. Вид формул, повторяемость в них целых чисел, универсальность постоянной Ридберга cвидетельствует о глубоком физическом смыс-ле этих закономерностей, не объясняемых в рамках классической физики.
Постулаты Бора
Идея Бора заключалась в сведение в единое целое эмпирические закономерности линейчатых спектров, ядерную модель Резерфорда и квантовый характер излучения и поглощения света.
Первый постулат Бора
В атоме существуют стационарные (не изменяющиеся со временем) состояния, характеризующиеся определенными дискретными значениями энергии, в которых он не излучает энергию.
Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения  момента импульса, удовлетворяющие условию
момента импульса, удовлетворяющие условию
где  mе — масса электрона, vn — его скорость по n-й орбите радиуса гn,
mе — масса электрона, vn — его скорость по n-й орбите радиуса гn,
Второй постулат Бора
 При переходе электрона с одной орбиты на другую излучается (поглощается) один фотон с энергией
При переходе электрона с одной орбиты на другую излучается (поглощается) один фотон с энергией
равной разности энергий соответствующих стационарных состояний (Еn и Еm соответ-ственно энергии стационарных состояний атома до и после излучения (поглощения)).
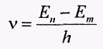 При Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn < Еm — поглощение фотона (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту).Набор возможных дискретных частот
При Еn > Еm происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т. е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Еn < Еm — поглощение фотона (переход атома в состояние с большей энергией, т. е. переход электрона на более удаленную от ядра орбиту).Набор возможных дискретных частот
квантовых переходов определяет линейчатый спектр атома.
Опыты Франка и Герца
Цель опытов: доказательство существования в атомах стационарных состояний, т. е. экспери-ментальное подтверждение постулатов Бора.
Экспериментальная устан овка
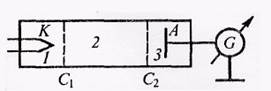 Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути.
Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути.
 Электроны, которые после соударения имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода.
Электроны, которые после соударения имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода.
Опытные данные
Ближайшим к основному, невозбужденному, состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ.Пока разность потенциалов между катодом и сеткой меньше 4,86В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При eφ = 4,86эВ энергияэлектрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального энергетического состояния на возбужденный энергетический уровень. Этим и объясняется первое резкое падение тока при eφ
|
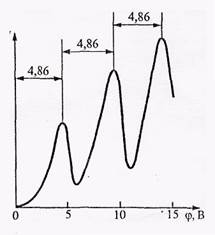
При энергиях, кратных 4,86 эВ, электроны испытывают 2, 3,... неупругих соударения и опять наблюдается резкое падение тока (см. рисунок).Итак, 4,86 эВ - наименьший квант энергии, поглощаемый атомом ртути в основном состоянии. Таким образом, в атоме действительно существуют стационарные состояния (подтверждение первого постулата Бора).
Атомы ртути, получившие при соударении с электронами энергию 
 Е, оказавшись в возбужденном состоянии, должны вернуться в основное, излучая, согласно второму постулату Бора, световой квант с частотой ν =
Е, оказавшись в возбужденном состоянии, должны вернуться в основное, излучая, согласно второму постулату Бора, световой квант с частотой ν =  Е/h (λ= 255нм) Опыт действительно обнаруживает подобную линию (подтверждение второго постулата Бора).
Е/h (λ= 255нм) Опыт действительно обнаруживает подобную линию (подтверждение второго постулата Бора).
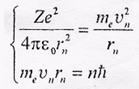 Радиус n -й стационарной орбиты определяется из уравнений
Радиус n -й стационарной орбиты определяется из уравнений
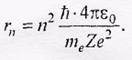 Решая эту систему уравнений, находим
Решая эту систему уравнений, находим

Первый боровский радиус
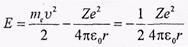 Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии и потенциальной энергии в электростатическом поле ядра:
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии и потенциальной энергии в электростатическом поле ядра:
 (здесь учтено, что
(здесь учтено, что
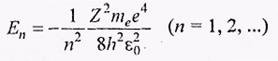 Учитывая квантованные для rn значения, получаем
Учитывая квантованные для rn значения, получаем
.(знак минус означает, что электрон находится в связанном состоянии).
Придавая n целочисленные значения,получаем для атома водорода (Z = 1)энергетические
уровни, схематически представленные на рисунке.

Атом водорода обладает минимальной энергией (E1 = -13,55 эВ) при n = 1 и максимальной ( = 0) при n =
= 0) при n =  (при удалении электрона из атома). Значение
(при удалении электрона из атома). Значение  =0 соответствует ионизации атома (отрыву от него электрона).
=0 соответствует ионизации атома (отрыву от него электрона).
Подставляя в обобщенную формулу Бальмера m = 1 и n = 2, 3, 4, получаем группу линий, образующих серию Лаймана, соответствующих переходам электронов с возбужденных уровней (n = 2,3,4,...) на основной (m = 1). Аналогично, при подстановке m = 2. 3, 4, 5, 6 и соответствующих им значений n получим серии Бальмера, Пашeна, Брэкета, Пфунда и Хэмфри, представленных схематически на рисунке).