ПРОМЫШЛЕННЫХ ТЕХНОЛОГИЙ И ДИЗАЙНА»
ВЫСШАЯ ШКОЛА ТЕХНОЛОГИИ И ЭНЕРГЕТИКИ
Институт технологии
Кафедра материаловедения и технологии машиностроения
Реферат
На тему «Химические соединения их свойства, кристаллические решетки»
| Выполнил(а): | студент учебной группы №822 Верещагина Екатерина Аркадьевна |
| (фамилия, имя, отчество) | |
| Проверил(а): | Жукова Мария Николаевна |
Санкт-Петербург
Содержание
Введение……………………………………………………………….. 3
Основные классы химических соединений………………………. 4
Отличия соединений от смесей.…………………………………….. 5
Свойства неорганических соединений.……………………………. 5
Свойства органических соединений..……………………………… 6
Кристаллические решетки.…………………………………………. 7
Литература……………………………………………………………... 12
Введение.
Химическое соединение — сложное вещество, состоящее из химически связанных атомов двух или более элементов. Некоторые простые вещества также могут рассматриваться как химические соединения, если их молекулы состоят из атомов, соединённых ковалентной связью.
Такие соединения образуются в результате химических реакций между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Сложные вещества могут разлагаться с образованием нескольких других веществ. Образование химических соединений сопровождается выделением (экзотермическая реакция) или поглощением (эндотермическая реакция) энергии. Физические и химические свойства химических соединений резко отличаются от свойств веществ, из которых они получены.
Основные классы химических соединений.
Неорганические - химические соединения, которые не являются органическими, то есть не содержат углерода (кроме карбидов, цианидов, карбонатов и оксидов углерода) и не имеющие характерного углеродного скелета. Например:
· оксиды (H2O, CaO, CO2, P2O5 (P4O10) и др.)
· гидроксиды:
основания (Na(OH), Ca(OH)2 и др.)
кислородосодержащие кислоты (HNO3, H2SO4, H3PO4 и др.)
амфотерные гидроксиды (Al(OH)3, Fe(OH)3 и др.)
· бескислородные кислоты (HCl, HCN и др.)
· нитриды (NH3, Si3N4 и др.)
· соли (NaCl, KNO3, Fe2(SO4)3, LiBr и др.)
· кристаллогидраты: (CuSO4·5H2O и др.)
· комплексные соединения: (K3[Fe(CN)6] и др.)
Органические – соединения, содержащие углерод (исключая карбиды, угольную кислоту, карбонаты, оксиды углерода и цианиды). Например:
· углеводороды
· спирты
· эфиры
· альдегиды
· кетоны
· карбоновые кислоты
· амиды
· амины

Отличия соединений от смесей.
Физические и химические свойства соединений отличаются от свойств смеси простых веществ — это один из главных критериев отличия соединения от смесей простых или сложных веществ, так как свойства смеси обычно тесным образом связаны со свойствами компонентов. Другим критерием отличия является то, что смесь обычно может быть разделена на составляющие нехимическими процессами, такими, как просеивание, фильтрация, выпаривание, использование магнитов, тогда как компоненты химического соединения могут быть разделены только при помощи химической реакции. И наоборот, смеси могут быть созданы без использования химической реакции, а соединения — нет.
Некоторые смеси связаны так тесно, что некоторые их свойства сходны со свойствами химических соединений, и их легко спутать. Наиболее частым примером таких смесей являются сплавы. Сплавы изготавливаются при помощи физических процессов, обычно — путём расплавления и смешивания компонентов с последующим остыванием. Другим примером смесей, не являющихся сплавами, являются интерметаллиды.
Свойства неорганических соединений.
Оксиды: кислотный оксид + вода = кислота (исключение - SiO2)
кислотный оксид + щелочь = соль + вода
кислотный оксид + основный оксид = соль
основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
амфотерный оксид + кислота = соль + вода
амфотерный оксид + щелочь = соль (+ вода)
амфотерный оксид + кислотный оксид = соль
амфотерный оксид + основный оксид = соль (при сплавлении)
Кислоты: кислота + основный оксид = соль + вода
кислота + амфотерный оксид = соль + вода
кислота + основание = соль + вода
кислота + амфотерный гидроксид = соль + вода
сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
Амфотерные гидроксиды:
амфотерный гидроксид + кислота = соль + вода
амфотерный гидроксид + щелочь = соль + вода (при сплавлении)
амфотерный гидроксид + щелочь = соль (в водном растворе)
Щелочи: щелочь + кислотный оксид = соль + вода
щелочь + кислота = соль + вода
щелочь + амфотерный оксид = соль + вода
щелочь + амфотерный гидроксид = соль (в водном растворе)
щелочь + растворимая соль = нерастворимое основание + соль
щелочь+ металл (Al, Zn) + вода = соль + водород
Соли: соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
растворимая соль + растворимая соль = нерастворимая соль + соль
растворимая соль + щелочь = соль + нерастворимое основание
растворимая соль металла + металл = соль металла + металл
Свойства органических соединений.
Характерные свойства:
· атомы углерода в молекулах органических соединений способны соединяться друг с другом;
· атомы углерода в молекулах органических соединений образуют цепи и кольца, что является одной из причин многообразия органических соединений;
· связи между атомами в молекулах органических соединений ковалентные. В своем большинстве органические вещества являются неэлектролитами, т.е. не диссоциируют на ионы в растворах, а также сравнительно медленно взаимодействуют друг с другом.
· для органических соединений характерно явление изомерии, в связи с чем имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом, одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
· многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Химические свойства:
Реакции органических веществ классифицируют по типу разрыва связей на:
· радикальные реакции, протекающие с гомолитическим разрывом ковалентной связи А:В → А. + В.
· ионные реакции, протекающие с гетеролитическим разрывом ковалентной связи А:В → А:— + В+
По типу реакции:
· присоединение RCH=CH2 +XY → RCHX + CH2Y
· замещение RCH2X + Y → RCHY + X
· отщепление (элеменирование) RCHX-CH2Y → RCH=CH2 + XY
· полимеризация N(CH2=CH2) → (-CH2-CH2-)n
Кристаллические решетки.
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называюткристаллической решеткой. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают 4 вида кристаллических решеток: ионные,атомные, молекулярные и металлические.
· Ионные - кристаллические решетки, состоящие из ионов. Их образуют вещества с ионной связью. Примером может служить кристалл хлорида натрия, в котором каждый ион натрия окружен 6 хлорид-ионами, а каждый хлорид-ион 6 ионами-натрия. Вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например, воде.
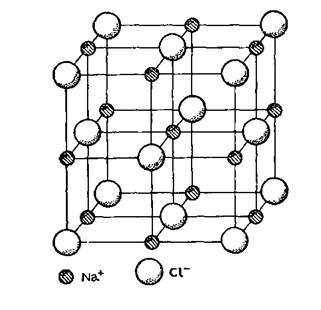
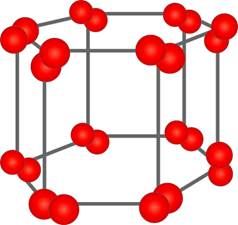
· Атомные: кристаллические решетки, в узлах которых находятся отдельные атомы. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с 4 соседними атомами. Координационное число углерода в алмазе равно 4. Вещества с атомной кристаллической решеткой имеют высокую температуру плавления (у алмаза свыше 3500 оС), прочны и тверды, практически не растворимы в воде.

· Молекулярные: кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкую температуру плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Примерами их являются лед, твердый СО2 («сухой лед»), галогены, кристаллы водорода, кислорода, азота, благородных газов и др.
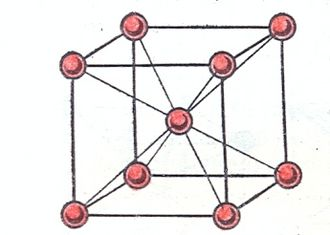
· Металлическая: тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Заключение.
В данной работе описаны свойства химических соединений и приведены проиллюстрированные примеры типов кристаллических решеток.
Литературный список.
1. https://studfiles.net/
Химическая Энциклопедия в 5 томах. ред. И. Л. Кнунянц. 5 том.