Вариант 1
Сколько граммов гидроксида кальция надо взять чтобы приготовить 500 мл 0,001 н раствора? Рассчитать массовую долю, моляльность и молярность вещества в растворе, если плотность раствора 1,08г/см3
Решение:
Рассчитаем массовую долю гидроксида кальция
Сн = 0,001 моль-экв/л
Сн = n/(ƒэкв·V) = m/(М · ƒэкв · V)
m = Сн · М ·ƒэкв · V
Для гидроксида кальция фактор эквивалентности ƒэкв = 1/произведение числа катионов на их заряд, т.о.
ƒэкв (Са(ОН)2)= ½
m (Са(ОН)2) = 0,001 · 74 ·½ · 0,5 л = 0,0185 г
Рассчитаем массовую долю:
m p-pa = V*p = 500*1.08 = 540 г
w(B)= m(B) / m * 100% = 0,0185 /540 * 100% = 0,0034%
Определим молярность:
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V) = 0,0185/(74 * 0,5) = 0,0005 моль/л
где М(B) - молярная масса растворенного вещества г/моль.
Определим моляльность:
Моляльность раствора m показывает количество растворённого вещества X в 1 кг растворителя:
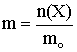 = 0,00025/0,54 = 0,000463 моль/кг
= 0,00025/0,54 = 0,000463 моль/кг
где n(X) – число моль растворённого вещества X, mо – масса растворителя в кг.

Получаем:
m (растворителя) = 540 – 0,0185 = 539,9815 (г).
Следовательно, в 1 л (1000 мл) раствора хлорида натрия (Са(ОН)2) содержится:
539,9815 ⋅ 1000 / 500 = 1079,963 (г) или 1,079963 кг – растворителя
Зная, что химическое количество (n) хлорида натрия (Са(ОН)2) равно 0,00025 моль, рассчитаем моляльность раствора по формуле:
m (Са(ОН)2) = 0,00025 / 1,079963 = 0,0002315 (моль/кг).
Ответ: 0,0185 г, 0,0034%, 0,0005 моль/л, 0,0002315 (моль/кг).
Вычислить потенциал водородного электрода в растворе, полученном смешиванием 30 мл 0,2М HClO4 и 40 мл 0,25М КОН.
Решение:
Потенциал водородного электрода Е 2Н+/Н2 = – 0,059рН
H+ + ОН– → Н2О
n(H+) = n(HClO4) = CV = 0,03 л ∙ 0,2 моль/л = 0.006 моль
n(ОН–) = n(КОН) = CV = 0,04 л ∙ 0,25 моль/л = 0.01 моль
Избыток ОН– составляет 0.004 моль.
[ОН–] = n(ОН–) / V = 0.004 моль / (0,03 л + 0,04 л) = 0,057 М
рН = 14 + lg[ОН–] = 14 + lg(0,057) = 9.87
Е 2Н+/Н2 = – 0,059рН = – 0,059 ∙ 9.87 = – 0,582 В
Ответ: – 0,582 В.
Рассчитайте рН смеси 20 мл 0,015 М раствора муравьиной кислоты и 25 мл 0,01 М раствора формиата натрия?
Решение:
НСООН→НСОО-+Н+
До добавления формиата натрия [Н+] = [НСOO-]
рН = -lg[Н+] = 2,79.
Рассчитаем концентрации муравьиной кислоты и формиата натрия после смешивания растворов:
При добавлении формиата натрия диссоциация муравьиной кислоты подавлена, следовательно [HCOO-]=c(HCOONa)=0,0055 моль/л
рН=3,67.
При добавлении формиата натрия рН раствора повышается за счет подавления диссоциации муравьиной кислоты в присутствии одноименного иона.
Ответ: 3,67.
Вариант 2
1. Сколько грамм 45%-ной серной кислоты надо взять, чтобы приготовить 920 мл 0,2н раствора этой кислоты? Чему равна молярная концентрация этого раствора?
Решение:
Определим количество эквивалента серной кислоты в растворе:
n экв.(H2SO4) = Cн*V = 0,2*0,92 = 0,184 моль-экв.
Определим массу вещества серной кислоты в растворе:
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98: 2 = 49.
m (H2SO4) = Mэкв.*n =49*0,184 = 9,016 г
Рассчитаем массу раствора:
m p-pa = m (H2SO4) *100% / w = 20.04 г
Молярная концентрация будет равна:
См = Сн*fэкв. = 0,184*1/2 = 0.092 моль/л
Ответ: 9,016 г, 0,092 г.
2. Раствор 0,05н муравьиной кислоты нейтрализован 0,05 н раствором гидроксида калия на 90%. Рассчитайте рН полученного раствора.
Решение:
H+ + ОН– → Н2О
Пусть объем раствора равен 1 л, тогда
n(H+) = n(HCOOH) = CV = 1 л ∙ 0,05 моль/л = 0.05 моль
n(ОН–) = n(NaОН) = CV = 1 л ∙ 0,05 моль/л = 0.05 моль
Т.к. раствор муравьиной кислоты нейтрализован раствором гидроксида калия на 90%, то в растворе осталось 10% от общего количества муравьиной кислоты, т.е. 0,05*0,1= 0,005 моль
Избыток Н+ составляет 0.005 моль.
[Н+] = n(Н+) / V = 0.005 моль / 1 л = 0,005 М
рН = - lg[Н+] = lg(0,005) = 2,3
Ответ: 2,3.
Смешаны равные объемы 0,4М раствора гидроксида аммония и 0,4М раствора нитрата аммония. Рассчитайте рН раствора.
Решение:
При смешении слабого основания с его солью получается щелочная буферная смесь.
Для щелочной буферной смеси рН = 14 – рКдис + lg(Cосн./Cсоли)
рКдис = – lg Kдис
рН = 14 + lg Kдис + lg(Cосн./Cсоли) = 14 + lg Kдис + lg (n осн./ n соли)
Если концентрации равны, (Сосн/Ссоль) = 1, а логарифм lg1 = 0.
Если концентрации равны, то рОH = pKb - lg(Сосн/Ссоль) = pKb - lg1 = pKb
pKb - справочная величина, для аммиака 4,76. Тогда, рОН = 4,76.
рН = 14 - рОН = 14 - 4,76 = 9,24.
Ответ: 9,24.
Вариант 4
1. Какие массы гексогидрата хлорида кальция и воды нужно взять для приготовления 250 г раствора с массовой долей хлорида кальция равной 10%. Чему равна молярная концентрация этого раствора?
Решение:
m(CaCl2)=m p-pa* w = 250*0.1=25 г
m(CaCl2*6H2O)=25*219/111=49 г (111 и 219 - это молярные массы хлорида кальция и гексагидрата хлорида кальция соответственно).
m(H2O)=250-49=201 г
Допустим, плотность раствора равна 1 г/см3, тогда молярная концентрация этого раствора будет равна:
V = m*p = 250*1 = 250 мл = 0,25 л
n = m/M = 25/219 = 0.11 моль
См= n/V = 0,11/0,25 = 0,46 моль/л
Ответ: 49 г, 201 г, 0,46 моль/л.
2. Как изменится значение рН 1 л исходного раствора хлороводородной кислоты при добавлении к нему 0,1 моль гидроксида натрия. Концентрация исходного раствора с(HCl) = 0,01 моль/л. Изменением объема раствора пренебречь.
Решение:
H+ + ОН– → Н2О
n(H+) = n(HCl) = CV = 1 л ∙ 0,01 моль/л = 0.01 моль
n(ОН–) = n(NaОН) = 0.1 моль
Избыток ОН– составляет 0.09 моль.
[ОН–] = n(ОН–) / V = 0.09 моль / 1 л = 0,09 М
рН = 14 + lg[ОН–] = 14 + lg(0,09) = 13.85
Ответ: 13,85.
3. Рассчитайте рН аммиачного буфера, в 1 л которого содержится 0,1 моль аммиака и 0,2 моль нитрата аммония NH4NO3. Константа основности аммиака Кв=1,76*10 -5; рКв = 4,76.
Решение:
При смешении слабого основания с его солью получается щелочная буферная смесь.
Для щелочной буферной смеси рН = 14 – рКдис + lg(Cосн./Cсоли)
рКдис = – lg Kдис
рН = 14 + lg Kдис + lg(Cосн./Cсоли) = 14 + lg Kдис + lg (n осн./ n соли)
n = CV
рН =14 + lg(1,76∙10^-5) + lg (0,1*1/0,2*1)) = 8.94
Ответ: 8,94.