Окислительное повреждение белков АФК ведет:
· к модификации боковых группировок аминокислотных остатков;
· к фрагментации полипептидных цепей;
· к образованию ковалентных связей (сшивок) как внутри молекул, так и между ними;
· к изменению функциональной активности белков, вплоть до полной инактивации этих молекул.
Данное обстоятельство справедливо и в случае тех белков, в отношение латентных предшественников которых активные формы кислорода могут первоначально выступать индукторами их функциональной активности. В свою очередь такой способ активации, не обусловленный триггерными механизмами организма, сам по себе несет негативный эффект.
Для оценки степени окислительной модификации белков под воздействием АФК используют уровень остаточной функциональной активности окисленного белка. Например, для ферментов - степень (глубину) и динамику их инактивации. Подход этот достаточно хорошо разработан на примере других повреждающих факторов (температурная или кислотная денатурация белков и др.). В этом случае процесс инактивации белка достаточно хорошо описывается экспоненциальной кривой падения его функциональной активности как от времени экспозиции белка в присутствии повреждающего фактора, так и от концентрации последнего (при фиксированном времени обработки инактивирующим фактором).
Для характеристики стабильности ферментов часто используются и эмпирические параметры, например, константы скоростей катализируемых ими реакций на определенной глубине инактивации этих биокатализаторов (обычно на глубине 50% или 75%). Сравнение величин констант скоростей реакций (k) для нативных и модифицированных ферментов дополняется и сопоставлением между собой таких параметров как ΔG≠, ΔH≠ (Ea) или ΔS≠. Причем, если после модификации белка величина ΔН≠ (следовательно, и Еa) изменяется незначительно, то эффект повреждающего фактора обусловлен лишь увеличением ΔS≠. Высокой устойчивостью к окислительной деструкции обладают антиоксидантные ферменты и специализированные белки-генераторы АФК. Среди ферментов-антиоксидантов наибольшей устойчивостью к окислительной деструкции обладает супероксиддисмутаза (СОД), наименьшей – глутатионпероксидаза, каталаза занимает промежуточной положение. СОД сохраняет способность катализировать диспропорционирование радикалов кислорода даже в условиях частичной окислительной фрагментации.
Как и в случае с ДНК наиболее мощным инициатором окислительной деструкции белков и повреждающим агентом выступает гидроксильный радикал. Результатом взаимодействия НО• с белками являются:
· их внутри- и межмолекулярные ковалентные сшивки как следствие рекомбинации образующихся свободно-радикальных структур в отсутствие О2 и О2-•;
· фрагментация молекул;
· модификация аминокислотных остатков (в том числе и образование гидроперекисных группировок, способных в присутствии доноров электронов приводить к дальнейшим превращениям по типу цепных реакций);
Процессы эти усиливаются в присутствии молекулярного кислорода и НО2•/О2-•, увеличивающих преимущественно содержание пероксидных (RОО•) радикалов и гидропероксидов (RООН), однако подавляющих в то же время образование ковалентных сшивок. Причиной образования внутри- и межмолекулярных сшивок является рекомбинация тирозил-радикалов (Туr•), образующихся либо в результате непосредственного взаимодействия НО• с тирозиновым остатком (Туr):
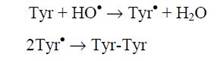
| (1) |
либо гидроксилированием фенилаланина (Рhе) до тирозил-радикала:
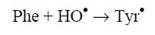
| (2) |
либо вследствие переноса свободной валентности с соседнего окисленного аминокислотного остатка, например, триптофанил-радикала (Тrр•) или метионил-радикала (Меt•):
| Trp· + Tyr «Trp + Tyr· Met· + Tyr «Met + Tyr· | (3) |
Переносу свободной валентности на остаток тирозина благоприятствуют более высокие значения редокс-потенциалов радикальных форм других остатков (за исключением цистеина) как акцепторов электронов. Даже у ароматического остатка триптофана эта величина составляет около +1.0 В (Е0 Тrр•/Тrр). Образующиеся (либо по сходному механизму, либо в результате прямой атаки цистеинила свободными радикалами) тиильные радикалы (R-S•) могут рекомбинировать друг с другом, формируя внутри- и межмолекулярные S-S-связи. Таким образом, наряду с образованием 2,2'-бифенольных сшивок, вклад в поперечносвязывающие процессы вносят и такие производные продуктов свободнорадикального окисления белков как S-S-связи:
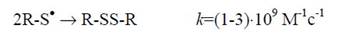
| (4) |
Ковалентные сшивки между полипептидными цепями могут формироваться также за счет Шиффовых оснований, образующихся в результате взаимодействия альдегидных производных некоторых аминокислотных остатков (вследствие их окислительной модификации) с NH2-группами белков:
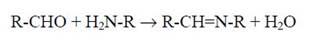
и в результате атаки такими альдегидами SН-групп белков. В последнем случае конъюгация реагентов будет происходить по механизму образования полумеркапталей:
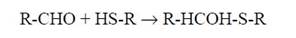
Однако роль битирозинов в конъюгации белков является ведущей, поскольку в присутствие О2 (или О2-•) поперечно-связывающие процессы подавляются и главным образом наблюдается расщепление пептидных связей (с сопутствующим ему образованием карбонильных группировок).