I. Общая характеристика элементов халькогенов.
O, S, Se, Te, Po

У всех этих элементов на внешней электронной оболочке 6 ē, поэтому они располагаются в VI группе.
| признак, по которому элементы располагаются в главной подгруппе |
4 р-ē
R0 - 6ē → R+6 - высшая степень окисления
R0 + 2ē → R-2 - низшая степень окисления
1. Образуют высшие оксиды - RO3 (SO3).
2. Образуют гидроксисды - кислоты H2RO4 (H2SO4, H2SeO4 и др.).
3. Образуют водородные соединения - RH2 (H2S, H2Se и др.).
II. Строение атома кислорода, образование молекулы.
| ковалентная неполярная связь |
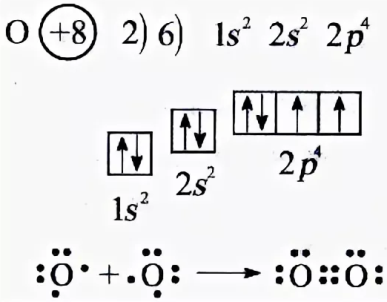
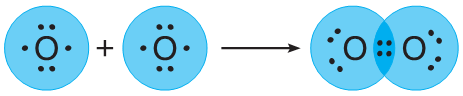
| электронная формула |

О = О структурная формула
О2 молекулярная формула
III. Аллотропия кислорода.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
| О - кислород | |
О2 - кислород

| О3 - озон

|
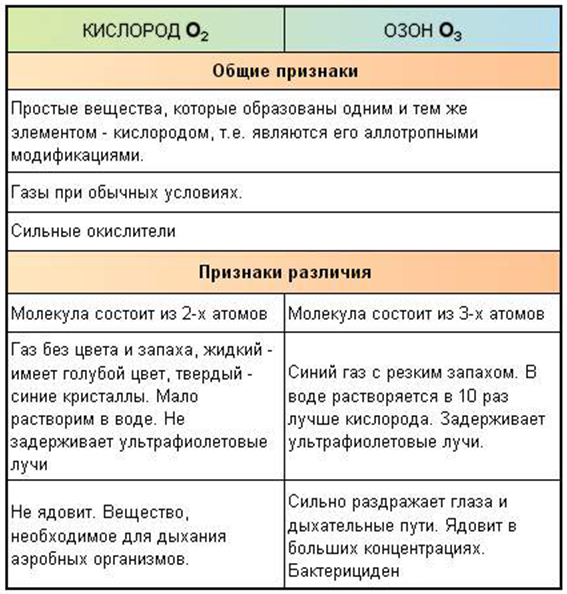
Озон О3 - газ голубого цвета со специфическим запахом - запахом свежести, появляется после грозы. Содержится в воздухе сосновых лесов и морского побережья.
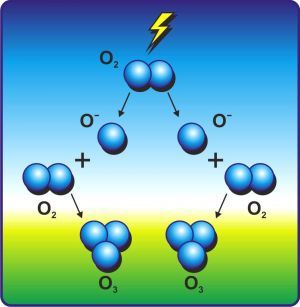
Получение озона в лаборатории.
Получают в специальных приборах – озонаторах при действии на кислород электрическим разрядом без искр.
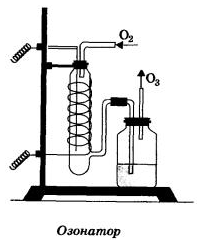
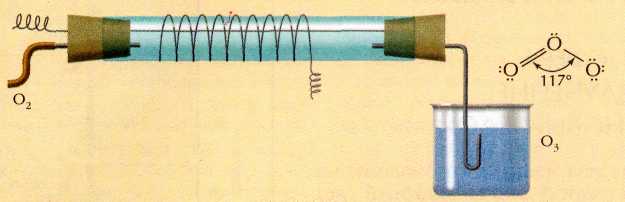
Значение озона для Земли.
• Озоновый слой расположен на высоте 20 – 25 км.
• Задерживает ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов.
IV. Физические свойства кислорода.
О2 - газ без цвета, вкуса и запаха, малорастворим в воде, поддерживает дыхание и горение, тяжелее воздуха. При t = -183°С - сжижается. Жидкий кислород имеет светло-голубой цвет, поэтому баллоны, в которых перевозят кислород - голубого цвета. Твёрдый кислород представляет собой кристаллы светло-синего цвета.
V. Получение кислорода.
1. В промышленности - из воздуха.
В лаборатории.
| t |
2KMnO4 → K2MnO4 + MnO2 + O2↑
| MnO2 |
2H2O2 → 2H2O + O2↑
3) На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия с углекислого газа, выдыхаемого человеком:
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
4) Разложение бертолетовой соли (хлората калия) KClO3.
2KClO3 → 2KCl + O2↑
| 100°С |
2HgO → 2Hg + O2↑

|
2H2O → 2H2↑ + O2↑
| t |
2NaNO3 → 2NaNO2 + O2↑
VI. Химические свойства кислорода.
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения со всеми элементами, кроме гелия, неона, аргона, образуя оксиды. Наиболее распространенная степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры.
Взаимодействие с простыми веществами - металлами.
В результате реакции образуется оксид этого металла.
2Cu + O2 → 2CuO
3Fe + 2O2 → Fe3O4
При сгорании щелочных металлов в кислороде получаются пероксиды:
2Na + O2 → Na2O2
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O2−). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
Na2O2 + О2 → 2NaO2
Калий К, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
К + О2 → КО2
Литий (в отличие от других щелочных металлов) образует нормальный оксид при сгорании на воздухе:
4Li + О2 → 2 Li2О