Теоретическая часть
Кинетика – это раздел химии, который занимается изучением закономерностей протекания химических реакций во времени.

Рисунок 1. Гомогенная кинетика и гетерогенная кинетика.
Кинетика имеет два подраздела: гомогенна кинетика и гетерогенная кинетика. Выше приведена схема (рис. 1), объясняющая разницу между ними.
Реакция, изучаемая в данной работе, является гомогенной и, следовательно, рассматриваться будет с точки зрения гомогенной кинетики.
В химической кинетике определяющей величиной является скорость химической реакции. Математически она определяется как отношение изменения концентрации ко времени:


где  – средняя (1) или мгновенная (2) скорость химической реакции,
– средняя (1) или мгновенная (2) скорость химической реакции,  – изменение концентрации исходного вещества (берётся со знаком минус, так как концентрация уменьшается, а скорость не может быть величиной отрицательной) или продукта реакции (берётся со знаком плюс),
– изменение концентрации исходного вещества (берётся со знаком минус, так как концентрация уменьшается, а скорость не может быть величиной отрицательной) или продукта реакции (берётся со знаком плюс), 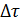 – изменение времени,
– изменение времени,  – приращение концентрации,
– приращение концентрации,  – приращении времени.
– приращении времени.
Скорость реакции зависит от:
1) Природы реагирующих веществ;
2) концентрации;
3) температуры;
4) наличия катализаторов (ускоряют реакцию);
5) наличия ингибиторов (замедляют реакцию).
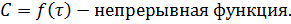
Также можно ввести понятие кинетического уравнение скорости:
Для реакции вида  можно записать кинетическое уравнение скоростей прямой и обратной реакций:
можно записать кинетическое уравнение скоростей прямой и обратной реакций:


где  – константа скорости прямой реакции,
– константа скорости прямой реакции,  – константа скорости обратной реакции,
– константа скорости обратной реакции,  – концентрации соответствующих веществ, стоящих в степенях, которые называются частными порядками реакции и определяются эмпирически. Сумма частных порядков реакции называется порядком реакции.
– концентрации соответствующих веществ, стоящих в степенях, которые называются частными порядками реакции и определяются эмпирически. Сумма частных порядков реакции называется порядком реакции.
Порядок реакции может отличаться от её молекулярности - числа молекул, участвующих в элементарном акте химического превращения.
Константа скорости k – это скорость реакции при единичных концентрациях, она зависит от:
1) Температуры T;
2) Наличия катализаторов/ингибиторов;
3) Природы участвующих в реакции веществ.
Реакции делятся на реакции первого и второго порядка.
К реакциям первого порядка относятся реакции разложения и радиоактивного распада. Общий вид реакций первого порядка:

где T – температура, V – объём.
Для реакций первого порядка можно записать кинетическое уравнение скорости:
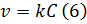
И сопоставить его с уравнением (2):



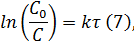
где  – начальная концентрация исходного вещества.
– начальная концентрация исходного вещества.
Можно определить, чему равно отношение 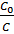 , введя величину начального количества реагирующего вещества a и количества исходного вещества, которое уже прореагировало
, введя величину начального количества реагирующего вещества a и количества исходного вещества, которое уже прореагировало 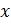 :
:

где  – количество исходного вещества в данный момент времени.
– количество исходного вещества в данный момент времени.




Общий вид реакций второго порядка:

Для таких реакций кинетическое уравнение будет иметь вид, представленный в уравнении (3). Если концентрации исходных веществ равны, можно записать:

где  – концентрация одного из исходных веществ.
– концентрация одного из исходных веществ.
Далее можно вывести формулу зависимости скорости реакции от количества прореагировавших веществ:


Таким образом, зная начальное количество реагирующих веществ и определив прореагировавшее количество в известный момент времени, можно определить константу скорости реакции, на чём и основана методика данного эксперимента.
Энергия активации. Уравнение Аррениуса. Теория активных соударений. Катализаторы и их влияние на скорость протекания реакции.
Как было сказано выше, константа скорости зависит от температуры, наличия катализаторов или ингибиторов и природы реагирующих веществ.
Зависимость константы скорости от температуры определяется уравнением Аррениуса, которое в дифференциальной форме имеет вид:

где  – константа скорости,
– константа скорости,  – температура (в кельвинах),
– температура (в кельвинах),  – универсальная газовая постоянная,
– универсальная газовая постоянная,  – энергия активации.
– энергия активации.
В данной работе исследуется изменение константы скорости при наличии катализатора, а температура постоянна.
Катализаторами называют вещества, способные ускорять химическую реакцию, при этом сами катализаторы в химической реакции не расходуются. Установлено, что катализаторы изменяют механизм химической реакции. При этом возникают другие, новые переходные состояния, характеризуемые меньшей высотой энергетического барьера. Таким образом, под действием катализатора снижается энергия активации процесса (рис. 2,3).
Для того, чтобы произошла реакция, частицам необходимо преодолеть отталкивание электронных оболочек молекул и разорвать или ослабить связи между атомами. Для этого необходимо затратить определённую энергию.
Избыточная энергия (по сравнению со средней энергией при данной температуре), которой должны обладать молекулы для протекания реакции, называется энергией активации.
Молекулы, обладающие такой энергией, называются активными молекулами.
Все молекулы в веществе находятся в состоянии непрерывного хаотического движения, в результате чего происходят столкновения между молекулами и обмен энергией.
Скорость химической реакции будет зависеть от доли активных молекул.
В ходе реакции молекулы вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Именно для его образования необходима энергия активации (рис. 2, 3).
Переходное состояние системы (активированный комплекс) - называется состояние системы реагирующих веществ, соответствующее максимальной энергии на пути реакции.
 Энергия активации – это количество дополнительной энергии, необходимой для перехода системы из исходного состояния в состояние активированного комплекса.
Энергия активации – это количество дополнительной энергии, необходимой для перехода системы из исходного состояния в состояние активированного комплекса.



Катализаторы направляют реакцию по другому пути, вследствие чего происходит изменение энергии активации.
Все реакции можно поделить на простые и сложные. Простые реакции протекают в одну стадию, а сложные – в несколько. Скорость сложной реакции определяется по самой медленной (лимитирующей) стадии.
Реакции с катализаторами – всегда сложные.
Можно записать влияние катализатора на путь протекания реакции второго порядка:

1. стадия 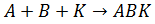
2. стадия 
Катализатор подбирается таким образом, чтобы он образовывал с исходными веществами переходный комплекс ABK, а лимитирующей стадией для реакции второго порядка была стадия 2.
Эквивалент.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях, одному электрону в окислительно-восстановительных реакциях или единице заряда в обменных реакциях между солями.
Эксперимент и методика.
Будет проведено две серии экспериментов, которые будут проходить в одних и тех же условиях и отличаться наличием или отсутствием катализатора (Cu2SO4) в составе реакционной смеси. Будут вычислены константы скорости для каждого случая и изменение энергии активации. В данном эксперименте будет исследоваться реакция окисления йодида натрия персульфатом натрия, протекающей в водном растворе по механизму реакции второго порядка.
Уравнение реакции:

Количество вещества будет определяться в моль-эквивалентах. Количество моль-эквивалентов иодида аммония и персульфата натрия будет браться одинаковым.

Это количество будет известно заранее.
Так же в раствор будет добавлен тиосульфат натрия, который будет реагировать с получающимся в ходе реакции (I) йодом с образованием иодида аммония:

Таким образом, количество участвующего в реакции (I) иодида аммония будет восстанавливаться до тех пор, пока в растворе не будет полностью израсходован запас тиосульфат натрия, количество которого будет так же определено заранее.
Этот момент можно определить, введя в раствор несколько капель крахмала. В процессе реакции (II) йод постоянно расходуется, однако, когда запас тиосульфата натрия будет израсходован, выделяющийся йод начнёт реагировать с крахмалом, придавая раствору синею окраску. Его количество в этот момент, и прореагировавшее количество одного из исходных веществ, будет равно начальной концентрации добавленного в раствор тиосульфата натрия. Этот момент будет зафиксирован на секундомере.
Таким образом, станут известны три искомые величины, необходимые для определения константы скорости: начальное количество исходных веществ, количество исходных веществ к определённому моменту времени, и само время.
По этим данным будет построен график, значение углового коэффициента которого и будет экспериментально определённым значением константы скорости исследуемой реакции.
Определённая таким образом константа скорости будет относиться только к заданной величине объёма реакционной смеси. Умножив эту константу на объём, находят константу скорости, не зависящую от объёма:

Размерности:




В эксперименте будут использоваться пять колб с засечками, по которым можно определить объём смешанной в них реакционной смеси, мерная колба, мерный стакан, пипетка, секундомер и сосуды с реагентами.
Используемые реагенты находятся в растворах, их нормальные концентрации нанесены на сосуды, в которых они хранятся.
Для расчёта количества эквивалентов реагентов, присутствующих в используемом объёме растворов, используются следующие формулы:

где V – объём данного реагента, измеренный мерной колбой,  – нормальная концентрация этого реагента. Множитель 1/1000 здесь появляется из-за того, что объём реагента будет измеряться в миллилитрах, а нормальная концентрация измеряется в моль-эквивалентах на литр.
– нормальная концентрация этого реагента. Множитель 1/1000 здесь появляется из-за того, что объём реагента будет измеряться в миллилитрах, а нормальная концентрация измеряется в моль-эквивалентах на литр.
Расчёт изменения энергии активации:
Решение уравнения Аррениуса (15):




Для эксперимента важно, чтобы общий объём реакционной смеси был постоянен и составлял 150 мл.
Таблица с расчётом объёмов растворов реагентов, необходимых для проведения эксперимента приведена ниже.