Лабораторная работа № 4
Тема: Химическая кинетика
Цель работы: исследование зависимости скорости химической реакции: 1) от концентрации реагирующих веществ; 2) от температуры процесса; 3) расчет энергии активации реакции.
Рекомендации: познакомиться с теоретическими основами работы по литературным источникам.
Важнейшие понятия: истинная и средняя скорости, константа скорости, кинетическое уравнение, энергия активации, кинетические условия самопроизвольного протекания процессов, механизм реакции, обратимые и необратимые реакции.
Следует уметь: записывать кинетическое уравнение для гомогенной и гетерогенной реакции; рассчитывать скорость химической реакции в начальный момент и на момент, когда прореагировала часть веществ; определять изменения скорости при изменении концентрации вещества, температуры и давления; рассчитывать энергию активации и константы скорости;
Контрольные вопросы и задания
1. Какие факторы влияют на скорость химических реакций в гомогенных и гетерогенных системах?
2. Как влияет природа реагирующих веществ на скорость химических реакций? Приведите примеры.
3. От каких факторов зависит константа скорости химической реакции?
4. Сформулировать и записать закон действующих масс для реакции:
2NO(г) + O2(г) = 2NO2(г)
5. Почему температура влияет на скорость химических реакций? Какизменяется скорость гомогенной реакции при повышении температуры на 40°С, если температурный коэффициент равен 2?
6. Что называется энергией активации? В каких единицах она выражается? Какая из двух приведенных реакций протекает с большей скоростью?
СО + Н2О = СО2 + H2 (энергия активации 98 кДж/моль) (1)
2HI = Н2 + I2 (энергия активации 186,4 кДж/моль) (2)
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществ
Для исследования предлагается реакция:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O
Реакция в ионно-молекулярном виде:
S2O3-2 + 2Н+ = SO2 + S↓ + Н2О.
Прежде чем приступать к выполнению эксперимента, рассмотрите применимость закона действующих масс для данной реакции (для упрощения используйте уравнение реакции в ионно-молекулярном виде). Изобразите графически вид зависимости скорости реакции при увеличении концентрации тиосульфата натрия, условно обозначив ее как 1С, 2С, ЗС (при постоянной концентрации серной кислоты). Определите порядок реакции по тиосульфат-ионам. Обсудите также вид зависимости скорости реакции от концентрации серной кислоты и изобразите графически вид этой зависимости, если концентрацию тиосульфат-ионов считать постоянной. Укажите порядок реакции по ионам водорода.
Методика выполнения опыта
Приготовьте три раствора тиосульфата натрия различной концентрации. Для этого в три пробирки налейте: в первую – 1 мл раствора Na2S2O3 и 2мл Н2О; во вторую – 2 мл Na2S2O3 и 1 мл Н2О; в третью – 3 мл того же раствора Na2S2O3. Затем в каждую пробирку добавьте по 1 мл раствора H2SO4 и измерьте время в секундах от момента добавления кислоты до появления первых признаков помутнения вследствие образования серы. Результаты опытов занесите в таблицу 1 и постройте график зависимости скорости реакции от концентрации тиосульфата натрия.
Опыт 2. Зависимость скорости реакции от температуры
Исследуется полуэмпирическое правило Вант-Гоффа и уравнение Аррениуса, графическое решение которого позволяет определить величину энергии активации реакции.
Методика выполнения опыта
В четыре пробирки налейте по 2 мл раствора Na2S2O3, каждую поставьте в стакан с горячей водой, соблюдая интервал температур воды в 100С, и через 3 – 5 минут измерьте температуру в стаканах термометром. Добавьте в каждую пробирку по 1 мл раствора H2SO4 и отметьте время от момента добавления кислоты до появления первых признаков помутнения. Результаты опытов внесите в таблицу 2 и постройте график, откладывая по оси абсцисс – температуру, а по оси ординат относительную скорость (величину, обратную времени).
Рассчитайте средний температурный коэффициент реакции, используя правило Вант-Гоффа в заданном интервале температур.
Для графического расчета энергии активации постройте зависимость 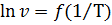 и по тангенсу угла наклона прямой определите энергию активации данной реакции.
и по тангенсу угла наклона прямой определите энергию активации данной реакции.
Студент: ФИО группа
Отчет к лабораторной работе
Химическая кинетика
Цель работы: исследование зависимости скорости химической реакции от концентрации реагирующих веществ и температуры.