I = R х 0,6 + E х 0,4
· Текущий контроль: лабораторные занятия и СРСП оцениваются посредством устного опроса, проверки оформления результатов занятий и т.д. СРС оценивается посредством защиты рефератов, докладов.
· Рубежный контроль: коллоквиум в форме письменного опроса по билетам или тестам.
· Итоговый контроль: тестовый экзамен в ЦТ с учетом результатов текущего контроля.
*Примечание:
Максимальный балл (на один семестр) за
- лекции = 6,0 балла (1 лекция = 0,4 балла, всего 15 лекций, итого 0,4 ´ 15 = 6,0 балла);
- практические занятия = 15,0 баллов (1 практическое занятие = 1,0 балла, всего 15 занятий, итого 1,0 ´ 15 = 15,0 баллов);
- СРСП = 16,0 баллов (1 СРСП = 1,0 балла, всего 16 СРСП, итого 1,0 ´ 16 = 16,0 баллов);
- СРС = 15,0 баллов (1 СРС = 2,5 балла, всего 6 СРС, итого 2,5 ´ 6,0 = 15,0 баллов);
- Рубежный контроль = 8,0 баллов (1 рубежный контроль = 2,0 баллов, всего 4 рубежных контроля, итого 2,0 ´ 4 = 8,0).
Итого текущий + рубежный контроль: 60 баллов.
Критерии оценки:
РД (рейтинг допуска) = ср.балл текущего контроля (лекции + пр.занятия) + ср.балл СРС ср.балл СРСП + ср.балл рубежного контроля
Текущий контроль:
1. Лекции - максимально 6,0 баллов
| Критерий | Балл за 1 лекцию | Балл за семестр (15 лекций) |
| Присутствие и полный ответ на контрольные вопросы | 0,3-0,4 | 4,5-6,0 |
| Присутствие и неполный ответ на контрольные вопросы | 0,1-0,25 | 1,5-3,75 |
| Присутствие, отсутствие ответа на контрольные вопросы | 0,05 | 0,75 |
| Отсутствие на лекции | ||
| Опоздание | минус 0,1 | минус 1,5 |
2. Практические занятия – максимально 15,0 баллов
| Традиционная оценка | Критерий | Балл за 1 занятие | Балл за семестр (15 занятий) |
| «5» | Присутствие, полный ответ при устном опросе, тестирование «86-100%», выполнение всех заданий | 0,86-1,0 | 12,9-15,0 |
| «4» | Присутствие, при опросе допущены незначительные ошибки, тестирование «75-85%», неточное выполнение заданий | 0,75-0,85 | 11,25-12,75 |
| «3» | Присутствие, при опросе допущены принципиальные ошибки, тестирование «60-74%», неполное выполнение заданий | 0,6-0,74 | 9,0-11,1 |
| «2» | Присутствие, незнание материала, тестирование (менее 60%), невыполнение заданий | 0,1-0,59 | 1,5-8,85 |
| Отсутствие на занятии | |||
| Опоздание | минус 0,2 | минус 3,0 |
|
|
3. СРСП – максимально 16,0 баллов
| Традиционная оценка | Критерий | Балл за 1 СРСП | Балл за семестр (16 СРСП) |
| «5» | Присутствие, полный ответ при устном опросе, тестирование «86-100%», выполнение всех заданий | 0,86-1,0 | 13,76-16,0 |
| «4» | Присутствие, при опросе допущены незначительные ошибки, тестирование «75-85%», неточное выполнение заданий | 0,75-0,85 | 12,0-13,6 |
| «3» | Присутствие, при опросе допущены принципиальные ошибки, тестирование «60-74%», неполное выполнение заданий | 0,6-0,74 | 9,6-11,84 |
| «2» | Присутствие, незнание материала, тестирование (менее 60%), невыполнение заданий | 0,1-0,59 | 1,0-9,44 |
| Отсутствие на занятии | |||
| Опоздание | минус 0,2 | минус 3,2 |
4. СРС - максимально 15,0 баллов
| Традиционная оценка | Критерий | Балл за 1 СРС | Балл за семестр (6 СРС) |
| «5» | Полное выполнение всех требований соответствующей формы СРС | 2,0-2,5 | 13,76-15,0 |
| «4» | Допущены незначительные ошибки, неточное выполнение задания | 1,5-1,9 | 12,0-13,6 |
| «3» | Допущены значительные ошибки, неполное выполнение заданий | 1,1-1,4 | 9,6-11,84 |
| «2» | Допущены принципиальные ошибки, невыполнение заданий, несоответствие критериям СРС | 0,5-1,0 | 1,0-9,44 |
| Отсутствие СРС |
|
|
Рубежный контроль:
За 1 РК - максимально 2 балла
Балл по рубежному контролю определяется по формуле:
- 86-100 % - 1,72 – 2,0 балла
- 75-85% - 1,5 – 1,7 балла
- 50-74% - 1,0 – 1,48 балла
- меньше 50 % - 0,98 балла и менее
РИК (рейтинг итогового контроля) - макс. 40 б.
= баллы за тестирование или баллы за устный экзамен
ИР (итоговый рейтинг) = РД (рейтинг допуска) + РИК (рейтинг итогового контроля)
Макс.- 100 баллов
ИР = процентному содержанию оценки.
В экзаменационную ведомость выставляется итоговая оценка по дисциплине в цифровом и буквенном эквиваленте баллов согласно приведенной ниже таблице.
Буквенно-балльно-рейтинговая оценка по дисциплине
| Оценка по буквенной системе | Цифровой эквивалент баллов | Процентное содержание % | Оценка по традиционной системе |
| А | 4,0 | 95-100 | ОТЛИЧНО |
| А- | 3,67 | 90-94 | |
| В+ | 3,33 | 85-89 | ХОРОШО |
| В | 3,0 | 80-84 | |
| В- | 2,67 | 75-79 | |
| С+ | 2,33 | 70-74 | УДОВЛЕТВОРИТЕЛЬНО |
| С | 2,0 | 65-69 | |
| С- | 1,67 | 60-64 | |
| D+ | 1,33 | 55-59 | |
| D | 1,0 | 50-54 | |
| F | 0-49 | НЕУДОВЛЕТВОРИТЕЛЬНО |
Лекционный комплекс
Кредит № 1
1. Тема 1-2 – Введение в токсикологическую химию. Основные разделы токсикологической химии. Основные направления химико-токсикологического анализа (ХТА). Организация проведения химико-токсикологической экспертизы в РК.
2. Цель: Ознакомить студентов с предметом токсикологическая химия и химико-токсикологическим анализом; с проблемами ХТА на современном этапе; задачами проведения химико-токсикологической экспертизы отравлений; основными документами, регламентирующими производство химическо-токсикологической экспертизы, чтобы студент знал и мог руководствоваться ими в своей практической деятельности.
|
|
Тезисы лекции
Токсикологическая химия – наука непосредственно связанная с токсикологией и химией.
Токсикология – наука медицинская. Токсикология (от греч. toxicon - яд, logos – учение) – наука, изучающая свойства ядов и физических факторов, механизмы их действия на организм человека и разрабатывающая методы диагностики, лечения и профилактики отравления.
Токсикологическая химия изучает и объясняет теоретические основы методов выделения, обнаружения и количественного определения токсичных веществ не только из объектов биологического происхождения, но и из других объектов исследования.
Основные задачи, стоящие перед токсикологической химией, это разработка новых и совершенствование известных методов выделения, обнаружения и количественного определения как самих токсикологически важных веществ, так и продуктов их метаболизма. А также внедрение этих методов в практику ХТА.
Возникла токсикологическая химия из потребностей судебно-медицинской токсикологии, изучающей умышленные, случайные и другие отравления.
В прошлом, до 1965 г, токсикологическая химия называлась – судебная химия, т.к. все исследования проводились в основном по заданию судебных органов. Заключения играли большую роль в вынесении приговора.
Программой фармацевтического образования предусмотрено изучение только этих 3-х разделов:
1. раздел – ХТА токсикологически важных веществ,
2. раздел – экспресс-анализ острых отравлений живых лиц,
3. раздел – ХТА объектов исследования на наличие наркотических и других одурманивающих веществ.
Токсикологическая химия является одной из специальных фармацевтических дисциплин завершающих химическую подготовку фармацевта.
Токсикологическая химия занимает пограничную область между медицинскими, биологическими и химическими дисциплинами, изучаемыми на фармацевтическом факультете.
На занятиях по токсикологической химии вы будете осваивать методы ХТА.
ХТА – это совокупность научно обоснованных методов, применяемых на практике для выделения, обнаружения и количественного определения токсикологически важных веществ.
Химико-токсикологическое анализ должен осуществляться в предельно сжатые сроки, поскольку отравление как заболевание химической этиологии требует неотложной терапии. Ненаправленный анализ, т.е. поиск неизвестного яда, требует значительно большего времени, чем направленный анализ, базирующийся на определении природы токсиканта на начальном этапе химико-токсикологического исследования.
Методы ХТА подразделяются на 2 группы:
1.методы выделения т.в. из соответствующих объектов;
2.методы обнаружения и количественного определения выделенных веществ.
Объекты исследования или «вещественные доказательства». Объекты ХТА довольно разнообразны. Их можно подразделить на следующие группы:
1 гр. Объекты, изъятые из трупов лиц, умерших в результате отравлений ядовитыми веществами, к ним относятся: ткани и органы трупов, биологические жидкости -кровь и моча, рвотные массы и др. – это так называемый биоматериал.
2 гр. Объекты, которые могли быть причиной отравлений, т.е. остатки пищи, пищевые продукты, вода, напитки, части растений, лекарственные препараты, различные химические вещества и др.
3 гр. Части одежды, пятна на одежде, флаконы из под лекарств, посуда, из которой были приняты ядовитые вещества, и другие объекты, а также предметы, которые сохранили на себе следы преступлений.
4 гр. Объекты внешней среды – воздух, вода, почва.
Большинство токсических веществ в биоматериале находится в связанном виде с белковыми и другими веществами, причем в очень малых количествах. А биоматериал в свою очередь мешает обнаружению ядовитых веществ даже с помощью самых чувствительных реакций. Поэтому в ХТА вначале выделяют токсичные вещества из объектов исследования, а затем производят обнаружение и количественное определение их.
Для обнаружения и количественного определения токсичных веществ в ХТА используется ряд реакций и методов применяемых в аналитической и фармацевтической химии. Однако многие эти реакции и методы, ввиду малой чувствительности и не специфичности, непригодны для целей ХТА.
Для обнаружения веществ вызвавших отравление необходимо применять чувствительные реакции. Однако при использовании высокочувствительных реакций в вытяжках из биоматериала можно обнаружить вещества, не являющиеся причиной отравления, а являющиеся нормальной составной частью тканей организма (например, металлы) или терапевтической дозой принятой перед смертью с лечебной целью. Поэтому необходимо уметь правильно оценить результаты анализа.
В биологическом материале под влиянием ферментных систем и других факторов большинство токсичных веществ подвергается метаболизму. Поэтому для того, чтобы установить какое вещество послужило причиной отравления необходимо выделять из биоматериала и определять их метаболиты.
Знание теории токсикологической химии необходимо фармацевту (провизору) для выполнения обязанностей:
- судебно-медицинского эксперта-химика;
- судебного токсиколога;
- химика-токсиколога,
которые предусмотрены УПК, а также приказами и постановлениями МЗ РК.
Иллюстративный материал
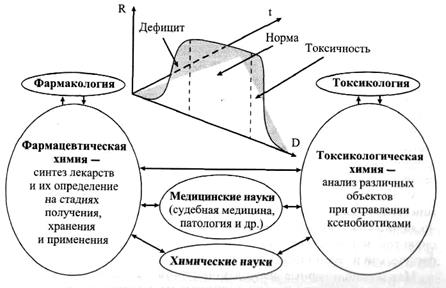
|
Рис. Кривая доза-ответ-время (D-R-t), демонстрирующая
взаимосвязь токсикологической химии с дисциплинами
медико-биологического и химического профиля
Литература
1. Калетина Н.И. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2008.
2. Плетенева Т.В. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2006.
3. Швайкова М.Д. Токсикологическая химия. – М.: Медицина,1975.
4. Бережной Р.В. Руководство по судебно-медицинской экспертизе отравлений. – М.:
Медицина,1999.
5.Крамаренко В.Ф. Токсикологическая химия. – Киев: Высшая школа, 1989.
6.Вергейчик Т.Х. Токсикологическая химия. – М.:МЕДпресс, 2009.
6. Контрольные вопросы (обратная связь)
1.Предмет и задачи токсикологической химии.
2.Основные разделы токсикологической химии:
- судебная химия – самый крупный и лучше всего разработанный раздел;
- ХТА объектов исследования на наличие наркотических и других одурманивающих средств;
- экспресс-анализ острых отравлений.
3.Связь токсикологической химии с другими дисциплинами преподаваемыми на фармацевтическом факультете.
4. Основные направления токсикологической химии.
5. Объекты исследования.
6. Особенности ХТА.
1. Тема 3-4 – Биохимическая токсикология. Токсикокинетика чужеродных соединений. Общие закономерности распределения веществ в организме. Факторы, влияющие на распределение. Основные токсикокинетические параметры распределения. Общая характеристика токсического действия.
2. Цель: Ознакомить студентов с вопросами, изучаемыми биохимической токсикологией; с подходами в классической и физиологической токсикокинетике к рассмотрению вопроса о поведении токсичных веществ в организме, чтобы студент знал и мог применить их в своей практической деятельности.
Тезисы лекции
В настоящее время токсикологическая химия как учебная дисциплина включает два основных раздела: биохимический и аналитический.
Биохимическая токсикология изучает токсикодинамику и токсикокинетику ксенобиотиков и их метаболитов: механизмы формирования токсического эффекта в системе токсикант-рецептор, скорости и механизмы поступления, распределения, биотрансформации, элиминации и экскреции токсикантов и их метаболитов. Токсикодинамика изучает механизмы формирования токсического эффекта на различных уровнях организации биосистемы - от молекулярного до организма в целом на этапах поступления, распределения, метаболизма (биотрансформации) и выведения токсичных веществ из организма. Токсикокинетика изучает кинетические закономерности этих процессов.
Аналитическая токсикология разрабатывает методы анализа для определения токсикантов в разнообразных объектах.
В классической токсикокинетике поведение токсичных веществ в организме рассматривается как движение между камерами, которые могут не иметь физиологических или анатомических аналогов. Камера представляет собой ограниченный в пространстве объем жидкости или ткани с одинаковой концентрацией токсиканта во всех точках ее пространства (рис. 1).
В физиологической токсикокинетике организм рассматривается как набор уравнений массопереноса между отдельными органами и тканями. Между классическими и физиологическими моделями нет противоречий; напротив, они дополняют друг друга.
Практическая цель токсикокинетики определяется в первую очередь количественной оценкой концентрации ксенобиотика в разных средах организма во времени. Эти данные необходимы при диагностике и лечении отравлений, а также при химико-токсикологических исследованиях и химико-токсикологическом анализе.
Токсикокинетические характеристики ксенобиотика зависят от многих факторов: физических и химических свойств вещества, объема органов и тканей, скорости кровотока, проницаемости капилляров и клеточных мембран, рН биосред и характеристик распределения между кровью и тканями. Формализовать влияние этих факторов удается, используя математический аппарат, описывающий токсикокинетические закономерности.
В основе изучения токсикокинетических параметров ксенобиотика лежит закон действующих масс для скорости.
Простейшая токсикокинетическая модель ксенобиотика — это однокамерная (одночастевая) модель без всасывания. Такая модель соответствует, например, внутривенному введению токсиканта в кровь. Роль камеры, или части, в этой модели играет кровь (рис. 3).
При проведении токсикокинетического исследования после внутривенной инъекции через определенные промежутки времени отбирают пробы и измеряют концентрацию ксенобиотика в плазме. Если при этом в полулогарифмических координатах lgC - t получается прямая линия, то кинетика ксенобиотика может быть описана однокамерной моделью и соответствует первому порядку (см. рис. 1).
Двухкамерная (двухчастевая) модель демонстрирует распределение вещества между центральной и периферической камерами (рис. 4).
При значительном увеличении дозы ксенобиотика скорость его распределения или элиминации может изменяться в соответствии с кинетикой насыщения. В этих случаях в токсикокинетических моделях насыщения используется уравнение Михаэлиса - Ментен, включающее два параметра (vmax и КМ):
v = (vmax · Ссвоб) / (КМ + Ссвоб),
где vmax — максимальная скорость распределения или элиминации; КМ — постоянная Михаэлиса, или концентрация ксенобиотика при скорости процесса, равной половине максимальной l/2vmax; Ссвоб — концентрация свободного (не связанного с белками или другими рецепторами) ксенобиотика.
В физиологических токсикокинетических моделях константы скорости отражают реальные или гипотетические биологические процессы. Физиологические модели имеют ряд преимуществ: они могут описывать распределение ксенобиотиков к любому реальному органу и ткани во времени; позволяют установить влияние физиологических параметров на содержание ксенобиотика в тканях; доступно описывают сложные режимы дозирования и процессы насыщения при метаболизме и комплексообразовании.
Структурная основа физиологической модели — это камера, которая является областью организма с одинаковой концентрацией ксенобиотика. Камера может быть специфической функциональной или анатомической частью органа, включающей отдельный кровеносный сосуд с окружающей его тканью. Камеры состоят из 3 тесно связанных подкамер: сосудистого пространства, которое снабжает камеру кровью; внутритканевого (интерстициального) пространства, где формируется клетка; внутриклеточного пространства (рис. 5).
В качестве реальной физиологической модели может быть рассмотрена модель из 4 подкамер, являющихся жидкостными камерами организма (рис. 6). Поступив из капилляров в интерстиций, ксенобиотик перемещается по трем направлениям: к клетке, обратно в кровеносный капилляр и в лимфатическую систему.
Получаемые из такой модели данные о скорости распределения ксенобиотика между жидкостными камерами организма могут быть использованы, например, при лечении гиперэлементозов и других заболеваний химической этиологии.
Иллюстративный материал

Рис. 1. Частевые (камерные) токсикокинетические модели.
kа — константа скорости первого порядка для процесса абсорбции ксенобиотика
из внесосудистого пространства в центральную камеру (1); kэл — константа скорости
первого порядка для процесса элиминации из центральной камеры; k1-2, k2-1 —
константы скорости первого порядка для распределения ксенобиотика в периферическую
камеру (2) и из нее для двухкамерной модели.

|
Рис. 2. Кривые концентрация—время для ксенобиотиков
в однокамерной (а, б) и двухкамерной (в, г) токсикокинетической модели
в прямых (а, в) и полулогарифмических (б, г) координатах.

|
Рис.3. Однокамерная токсикокинетическая модель.
kаб, kбиотр, kэкс, kэл — константы скорости абсорбции,
биотрансформации, экскреции и элиминации.

Рис. 4. Двухкамерная кинетическая модель.
kаб, kбиотр, kэкс, kэл, k1-2, k2-1 — константы скорости абсорбции, биотрансформации, экскреции, элиминации, перехода из центральной камеры в периферическую и обратно.

Рис. 5. Камера в физиологической
токсикокинетической модели (общая схема).
QK — кровоток; Свход — концентрация ксенобиотика на входе в камеру;
Свыход — концентрация ксенобиотика на выходе из камеры.

|
Рис. 9. Модель распределения ксенобиотика
между жидкостными камерами организма.
Литература
1. Калетина Н.И. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2008.
2. Плетенева Т.В. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2006.
6. Контрольные вопросы (обратная связь)
1. Что изучает токсикокинетика?
2. Объясните поведение токсичных веществ в организме с точки зрения классической токсикокинетики.
3. Чем определяется практическая цель токсикокинетики?
4. От каких факторов зависят токсикокинетические характеристики ксенобиотика?
5. В каких случаях кинетика ксенобиотика может быть описана однокамерной моделью?
6. В каких случаях кинетика ксенобиотика может быть описана многокамерной моделью?
7. Что собой представляет структурная основа физиологической токсикокинетической модели?
1. Тема 5-6 – Биотрансформация чужеродных соединений в организме. Этапы и основные пути биотрансформации. Факторы, влияющие на метаболизм чужеродных соединений. Метаболиты и токсичность.
2. Цель: Ознакомить студентов с основами биотрансформации чужеродных соединений в организме; с факторами влияющими на биотрансформацию чужеродных веществ в организме, чтобы студент знал и мог применить их в своей практической деятельности.
Тезисы лекции
Вещества, поступившие в организм с пищей, а также лекарственные и другие соединения под влиянием ферментов подвергаются различным превращениям. Процесс превращения поступивших в организм веществ называется метаболизмом, или биотрансформацней, а вещества, образующиеся при этих превращениях, называются метаболитами.
Белки, жиры, углеводы, гормоны, витамины и некоторые другие вещества, поступившие в организм, являются свойственными организму. Они служат источником энергии или являются структурными элементами для создания клеток, тканей и т. д. Эти вещества подвергаются метаболизму с помощью специфических ферментных систем, обеспечивающих жизнь тканей и деятельность организма.
Также в организм могут поступать лекарственные препараты, пищевые добавки, химические средства защиты растений, предметы бытовой химии и многие другие вещества, которые не свойственны организму. Они не обеспечивают энергией все нуждающиеся в ней формы жизнедеятельности и не превращаются в компоненты клеток и тканей. В определенных условиях эти вещества могут нарушать нормальные процессы метаболизма белков, жиров и других свойственных организму соединений, вызывать отравления и даже смерть. Такие вещества называются чужеродными или ксенобиотиками.
Преобладающее число метаболитов является менее токсичным, чем чужеродные вещества, из которых они образовались. Хотя есть исключения, метиловый спирт менее токсичный, чем формальдегид, являющийся метаболитом спирта. При метаболизме кодеина может образовываться морфин, более токсичный, чем кодеин.
Метаболиты легко выводятся из организма. Поэтому метаболизм лекарственных веществ и особенно ядов является одним из путей детоксикации - процесса обезвреживания ядов и ускорения их выделения из организма. Изучение метаболизма представляет большой интерес для фармакологов, токсикологов, клиницистов.Физические и химические свойства большинства метаболитов отличаются от свойств чужеродных соединений, из которых они образовались. Поэтому методы выделения чужеродных соединений из биологического материала, применяемые в химико-токсикологическом анализе, во многих случаях непригодны для выделения метаболитов, что может привести к их частичной или полной потере.
Метаболизм чужеродных соединений (лекарственных препаратов, ядов и др.) в организме людей и животных происходит под влиянием ферментных систем. Большинство из ядов метаболизируются в печени, в которой продуцируется значительное число ферментов.
Многие ферменты, под влиянием которых происходит метаболизм чужеродных соединений, присущи организму. Они катализируют превращение близких по химической природе веществ. Некоторые же ферменты в организме отсутствуют, но они образуются в процессе метаболизма. В этих случаях чужеродные соединения индуцируют образование ферментов, которые катализируют их метаболизм. Такие ферменты называются индуцированными.
Можно отметить, что метаболиты являются полярными, чем чужеродные вещества, из которых они образовались. С увеличением полярности метаболитов возрастает их растворимость в воде. Это обстоятельство приводит к увеличению возможности выделения метаболитов из организма через почки с мочой.
Изменения метаболизма чужеродных веществ могут зависеть от возраста, пола, питания, различных заболеваний, стрессовых состояний, наличия других чужеродных соединений в организме и других факторов.
Метаболизм ряда чужеродных соединений происходит в две фазы:
1) В первой фазе под влиянием ферментных систем чужеродные соединения превращаются в их метаболиты.
2) Во второй фазе метаболиты и некоторые чужеродные соединения с определенными веществами, находящимися в организме, образуют конъюгаты.
В первой фазе метаболизма под влиянием ферментных систем чужеродные соединения могут подвергаться окислению, восстановлению, гидролизу, дезаминированию, дезалкилированию, десульфированию и другим превращениям.
При окислении под влиянием ферментов происходит превращение многих чужеродных соединений в их метаболиты, содержащие гидроксильные (спиртовые, фенольные) группы. Поэтому такие реакции окисления называются реакциями гидроксилирования. При окислении некоторых чужеродных соединений, содержащих азот и серу, образуются оксиды и другие соединения.
Первичные спирты (этиловый, бутиловый, бензиловый и др.) с помощью фермента алкогольдегидрогеназы, которая локализуется в печени, почках и легких, окисляются в соответствующие альдегиды.
Вторичные спирты в организме окисляются до кетонов. Однако скорость окисления этих спиртов в организме значительно меньше, чем скорость окисления первичных спиртов. Высшие вторичные и третичные спирты в организме окисляются медленно.
Альдегиды алифатического и ароматического ряда под влиянием ферментов окисляются в соответствующие карбоновые кислоты. Бензальдегид под влиянием альдегидоксидазы превращается в бензойную кислоту:
Кроме окислительных ферментных систем в печени, почках, крови содержатся ферментные системы, способствующие восстановлению чужеродных соединений в организме. Эти ферментные системы катализируют восстановление ароматических нитросоединений в амины.
С помощью ферментов (редуктаз) происходит восстановление нитробензола в анилин, п-нитрозобензойной кислоты в п-аминобензойную кислоту и т д. Восстановление нитросоединений в амины происходит через образование ряда промежуточных продуктов.
Под влиянием соответствующих ферментов в организме происходит восстановление дисульфидов, сульфоксидов, N-оксидов, гидроксамовых кислот и ряда других чужеродных соединений.
В организме ряд чужеродных соединений, к числу которых относятся сложные эфиры, амиды, гидроксамовые кислоты, карбаматы, нитрилы и другие вещества, под влиянием ферментных систем подвергается гидролизу. С помощью ряда гидролитических ферментов, находящихся в печени и плазме крови, гидролизуются сложные эфиры и амиды. Однако гидролитическое расщепление амидов происходит медленнее, чем расщепление эфиров с помощью эстераз.
Наиболее часто процессу дезалкирования подвергаются соединения, содержащие алкильные группы при атомах кислорода, азота и серы. В зависимости от этого процессы отщепления алкильных групп подразделяются на О-, N- и S-дезалкилирование. При дезалкилировании указанных соединений образуются соответствующие фенолы, амины и тиолы (тиофенолы, тиоспирты).
Чужеродные соединения, являющиеся вторичными и третичными аминами, в организме подвергаются N-дезалкилированию. В результате этого образуются соответствующие амины и альдегиды. Так, диметиланилин метаболизируется с образованием метиланилина, превращающегося в анилин и формальдегид.
Во второй фазе метаболизма происходит конъюгация метаболитов с некоторыми веществами, находящимися в организме. Реакции конъюгации являются реакциями биосинтеза. Известны чужеродные соединения, которые, минуя первую стадию биотрансформации (не превращаясь в метаболиты), вступают в реакции конъюгации. Способность чужеродных соединений и метаболитов вступать в реакции конъюгации зависит от наличия в их молекулах определенных функциональных групп.
В результате реакций конъюгации в организме образуются конъюгаты, которые являются полярными, лучше растворимыми в воде и менее токсичными, чем чужеродные соединения. Поэтому в результате процессов конъюгации происходит понижение токсичности чужеродных соединений (лекарственных препаратов и ядов) и увеличение скорости выделения их из организма. Таким образом, реакции конъюгации являются реакциями детоксикации.
В организме метаболиты и некоторые чужеродные соединения под влиянием соответствующих ферментов могут образовывать конъюгаты с глюкуроновой кислотой, аминокислотами (глицином, цистеином и др.), ацетатами, сульфатами и рядом других веществ.
Имеется ряд ферментов, активность которых зависит от наличия определенных групп (или молекул) небелковой природы, которые называются кофакторами. В роли кофакторов могут выступать сложные органические вещества, которые называются коферментами или ионы металлов.
При конъюгации с глюкуроновой кислотой образуются уроновые кислоты (глюкуроновая, маннуроновая, галактуроновая) являются компонентами многих полисахаридов, олигосахаридов и др. В организме свободная глюкуроновая кислота образуется при ферментативном гидролизе УДФ-глюкуроновой кислоты, некоторых глюкопротеидов и других веществ.
Продукты взаимодействия глюкуроновой кислоты со спиртами, фенолами, карбоновыми кислотами, тиолами, аминами и некоторыми другими веществами называются глюкуронидами.
В организме метилированию могут подвергаться амины, фенолы и тиолы. В результате метилирования образуются соответствующие N-, О- и S-метильные конъюгаты. При метилировании чужеродных соединении и некоторых метаболитов переносчиком метальных групп является кофермент S-аденозилметионин. С участием метальных групп этого кофермента происходит метилирование перечисленных выше соединений. Реакции метилирования происходят под влиянием ферментных систем (метилтрансфераз).
Процесс ацетилирования является основным путем метаболизма ароматических аминов, сульфаниламидов и некоторых чужеродных аминокислот. При ацетилировании происходит присоединение ацетильной группы к молекулам чужеродных соединений или метаболитов. Источником ацетильных групп, реагирующих с чужеродными соединениями или метаболитами, является кофермент ацетил-КоА (КоА - пантетеинароновая кислота). Под влиянием фермента ацетилтрансферазы происходит перенос ацетильной группы от ацетил-КоА к соответствующим аминам, сульфамидам и аминокислотам, подвергающимся конъюгации, и освобождается КоА.
Ароматические карбоновые кислоты, замещенные бензойной кислоты и гетероциклические карбоновые кислоты с глицином (гликоколем) H2N-СН2СООН и другими α-аминокислотами, образуют конъюгаты. Глициновые конъюгаты бензойной, салициловой, никотиновой и других кислот встречаются под название гипуровые кислоты. Алифатические карбоновые кислоты с глицином не образуют конъюгатов. В качестве конъюгирующего агента иногда является цистеин, представляющий собой α -аминокислоту.
Глютатион - сложный природный трипептид (глютаминал-цистеинил-глицин), с бензолом, нафталином и антраценом образует конъюгаты (меркаптуровые кислоты). Образование конъюгатов с глютатионом катализирует фермент глютатион- S-арилтрансфераза.
Фенолы и спирты в организме конъюгируются с сульфатами. При этом образуются конъюгаты, представляющие собой эфиры этих веществ. В организме источником сульфатов, вступающих в реакции конъюгации, является З-фосфоаденозин-5-фосфосульфат. Реакция образования конъюгатов спиртов и фенолов катализируется ферментом сульфотрансферазой.
В ряде случаев чужеродные вещества метаболизируются несколькими путями. Сложные эфиры гидролизуются с образованием кислот и спиртов. Спирты, в свою очередь, могут окисляться до кислот, которые вступают в реакции конъюгации с глицином. Сульфаниламиды могут метаболизироваться путем окисления их и путем конъюгации с ацетатами. Нитросоединения восстанавливаются до аминов, которые затем ацетилируются.
Скорость процессов метаболизма различных чужеродных соединений неодинакова. Процесс метаболизма некоторых чужеродных соединений не доходит до конца. Поэтому одни чужеродные соединения частично выделяются из организма в неизмененном виде, а другие - в виде смеси, состоящей из чужеродных соединений, метаболитов и конъюгатов.
Иллюстративный материал