1 – ый дистиллят: весь объем (3мл.) исследуют на HCN и цианиды. Реакция является доказательной на наличие синильной кислоты.
2 – ой дистиллят:
А) часть дистиллята исследуют на галогенопроизводные углеводородов:
1) реакция отщепления органически связанного хлора со спиртовым раствором NaOH (все дают эту реакцию);
2) реакция образования изонитрола при положительном результате, далее проводят исследование на СНС13 и CС13CH (OH)2;
3) реакция с резорцином в щелочной среде;
4) реакция с реактивом Фелинга;
5) при положительных результатах предыдущих реакции проводят реакцию отличия СНС13 и СС13СН(ОН)2 с раствором Несслера.
Б) часть 2-го дистиллята исследуют на формальдегид:
1) с фунсинсернистой кислотой (при рН 0,7 – специфичнв на формальдегид),
2) с хромотроновой кислотой,
3) с резорцином в щелочной среде,
4) с кодеином и концентрированной серной кислотой.
В) если в дистилляте обнаружен СН2О, то только после его отгонки проводят исследование на
СН3ОН – т.к. обнаружение метанола проводят в основном по продукту его окисления, т.е. по СН2О:
1) реакция образования метилсалицилата не специфична т.к. ее дают
и С2Н5ОН сходный по запаху;
2) после окисления до СН2О раствором KМnO4 в присутствии H2SO4 (избыток окислителя удаляется + Na2SO3, NaHSO3, H2C2O4 и другими):
а) с хромотроповой кислотой (из всех специфичная эта реакция на СН3ОН) реакция,
б) с фуксинсернистой кислотой ее не дают: С2Н5ОН, С3Н7ОН, С4Н9ОН, С5Н11ОН и изоамиловые спирты;
в) с резорцином в щелочной среде.
Г) Далее проводят исследование на С2Н5ОН:
1) реакция образования йодоформа,
2) реакция образования этилацетата,
3) реакция образования этил бензоата (с бензоилхлоридом),
4) реакция образования ацетальдегида,
5) окисление С2Н5ОН и обнаружение его по ацетальдегиду:
а) по реакции с нитропруссидом Na и морфолином для отличия СН3ОН от С2Н5ОН.
3 – ий дистиллят + остаток 2-го дистиллята:
а). исследуют на фенол: Учитывая плохую растворимость фенола в воде, его экстрагируют из дистиллята эфиром после подщелачивания гидрокарбонатом натрия до рН 8-9 (уксусная, салициловая, молочная кислоты образуют соли и не экстрагируются эфиром). Эфирные извлечения упаривают и реакции проводят с сухим остатком.
1) реакция с бромной водой (имеет отрицательное судебно-химическое значение). При положительном результате реакции с бромной водой проводят другие реакции,
2) индофеноловая реакция,
3) реакция с FeCI3.
б). на изоамиловый спирт: Учитывая плохую растворимость изоамилового спирта в воде, его экстрагируют из дистиллята эфиром (избыток воды, спирта, минеральной кислоты мешеает проведению реакции).
1) реакция с салициловым альдегидом,
2) реакция с п – диметиламинобензальдегидом,
3) реакция образования изоамилацетата (грушевая эссенция),
4) реакция окисления изоамилового спирта до изовалерианового альдегида и до изовалериановой кислоты (по запаху).
4. Иллюстративный материал - по ходу чтения лекции схема исследования рисуется на доске или на прозрачной пленке и проецируется на экран.
Литература
1. Калетина Н.И. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2008.
2. Плетенева Т.В. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2006.
3. Крамаренко В.Ф. Токсикологическая химия. – Киев: Высшая школа, 1989.
4. Швайкова М.Д. Токсикологическая химия. – М.: Медицина,1975.
5. Белова А.В. Руководство к практическим занятиям по токсикологической химии.- М.:
Медицина, 1976.
6. Контрольные вопросы (обратная связь)
1. На наличие, какого «летучего яда» проводится исследование 1-го дистиллята?
2. Почему для доказательства синильной кислоты в дистилляте, полученном из биологического
материала, проводится только одна реакция образования берлинской лазури?
3. Какие реакции проводятся для доказательства наличия галогенопроизводных углеводородов?
4. Какие галогенопроизводные углеводородов не дают реакцию образования изонитрила?
5. С чем проводится отличительная реакция хлороформа от хлоралгидрата и какой аналитический сигнал свидетельствует о положительном результате реакции?
6. Почему исследование на наличие метилового спирта проводят после исследования на
формальдегид?
7. Перечислите реакции, проводимые на этиловый спирт.
8. Для чего дистиллят подщелачивают и проводят экстрагирование эфиром перед проведением
исследования на фенол?
9. Для чего изоамиловый спирт экстрагируют эфиром из дистиллята перед проведением
исследования на него?
1. Тема 3 – Проблема экспертизы алкогольного опьянения. Токсикокинетика этилового спирта. Количественная диагностика опьянения. Методы анализа, применяемые в наркологии и судебно-химической экспертизе. Газохроматографический метод исследования этилового спирта.
2. Цель: Ознакомить студентов с токсикокинетикой и методами анализа этилового спирта, применяемыми в наркологии и СХЭ, чтобы студенты знали и могли применить их в своей практической деятельности.
Тезисы лекции
Для медицинского применения по решению Фармакологического комитета РК разрешены спирты, получаемые только из пищевого сырья. Синтетический этиловый спирт внесен в Список ядовитых веществ Постоянного комитета по контролю наркотиков (ПККН). В нашей стране синтетический спирт запрещен и для наружного применения у людей.
На основе происхождения сырья этиловые спирты делят на синтетические, полученные прямой гидратацией этилена или его гидратацией с применением серной кислоты, и ферментативные, полученные путем сбраживания растительного сырья (пищевого и непищевого) ферментами дрожжевых грибов рода Sacharomyceties. В табл. 1 приведены марки и номера технической документации этиловых спиртов, производимых в РК.
Полученные тем или иным способом спирты, как правило, содержат характерные примеси (рис. 1).
Схема экспертного исследования спиртов с целью определения вида используемого при их изготовлении сырья состоит из нескольких этапов:
• изучение внешних признаков представленных на исследование объектов (прозрачность жидкости, цвет, запах, наличие посторонних примесей, особенность укупорки и др.);
• проведение газохроматографического исследования жидкости;
• проведение изотопного анализа жидкости.
Газохроматографическое исследование спиртов проводят в настоящее время на капиллярной колонке длиной 50 м и более, на внутреннюю поверхность которой нанесена полярная неподвижная фаза, например модифицированный полиэтиленгликоль (FFAP или HP-Innowax).
В качестве детектора применяют пламенно-ионизационный (ПИД) или масс-селективный (МС) детекторы. Дифференцировка этилового спирта по исходному сырью, использованному для его изготовления, методом изотопного анализа основана на определении удельной активности 14С* и 3Н в исследуемых объектах.
Особенности фармакокинетики этанола необходимо знать, для того чтобы правильно оценивать соотношения между принятой дозой спиртных напитков, концентрацией этилового алкоголя в плазме крови и возникающими при этом клиническими признаками отравления, а также прогнозировать возможные осложнения и провести своевременное и адекватное лечение.
Принятые внутрь спиртные напитки всасываются преимущественно в тонкой кишке, лишь 20% дозы всасывается в желудке. На полноту абсорбции этанола и его концентрацию в плазме крови оказывают влияние принятые ранее или совместно с алкоголем другие биоактивные вещества или лекарственные препараты (табл. 2).
У здоровых людей на «голодный желудок» абсорбция этилового спирта завершается в течение 1 ч после однократного приема спиртных налитков. Пища существенно задерживает их абсорбцию. 20% растворы этанола всасываются быстрее, особенно в сочетании с гидрокарбонатными водами, концентрированные растворы (водки «Сибирская», «Смирнофф», разведенный или «чистый» спирт) всасываются медленнее за счет вызываемого ими пилороспазма и задержке выпитого в желудке. Назначение активированного угля не влияет на скорость абсорбции водки или спирта, однако уголь адсорбирует другие вещества, находящиеся в алкогольном напитке (ацетальдегид, этилацетат, сивушные масла, фурфурол и др.).
Биотрансформация этанола представляет собой типичную реакцию токсификации, при которой образуются более токсичные по сравнению с исходным продуктом метаболиты. 10% принятого внутрь спирта выводится почками и легкими в неизмененном виде, остальное количество окисляется в печени. Биохимические процессы, которые происходят в ней при биодеградации этилового алкоголя, очень важны для понимания природы осложнений, возникающих при интоксикации им.
Основной путь биотрансформации этилового спирта — его окисление цитозольной алко-гольдегидрогеназой до ацетальдегида, который далее окисляется в митохондриях гепатоциов альдегиддегидрогеназой до уксусной кислоты. Последняя утилизируется в цикле Кребса. Обе дегидрогеназы расщепляют этанол с постоянной скоростью, которая составляет 7—10 г этанола в 1 ч, потребляют НАД+, который восстанавливается до НАДН. Чем больше этанола принято человеком, тем меньшими становятся запасы НАД+ в клетках.
Вторым по значимости путем биотрансформации этанола является его окисление в эндо-плазматическом ретикулуме микросом (микросомальная этанолокисляющая система — МЭОС) с участием цитохрома Р450 (тип CYP2D6 — дебризохингидроксилаза). Этот путь биотрансформации включается при уровне этанола в плазме крови в среднем 1 г/л. При сформированной зависимости от этанола система МЭОС работает наравне с биотрансформацией дегидрогеназами, что при сохраненной функции печени проявляется повышенной толерантностью пациента к действию спиртного (выражение: «пьет, как лошадь»). Окисление алкоголя в системе МЭОС также приводит к образованию ацетальдегида, а в результате реакции блокируется окислительное фосфорилирование.
Окисление в пероксидкаталазной системе микросом клеток печени является третьим путем биотрансформации этанола, в результате которого образуется, помимо ацетальдегида, эндопероксида и НАДФН. Это приводит к дефициту НАДФ+ и торможению окислительного фосфорилирования. Последствия перечисленных реакций ферментативного катализа этанола представлены в табл. 8-6.
Средняя скорость метаболической элиминации у взрослого человека составляет 7—10 г этанола в 1 ч, что сопровождается снижением его концентрации в плазме крови на 0,15—0,20 г/л в 1 ч. У алкоголиков в силу сочетанной работы двух метаболических систем расщепление этанола происходит с большей скоростью, которая достигает 0,30 — 0,40 г/л в 1 ч. У детей она составляет 0,28 г/л в 1 ч.
Основным критерием, отражающим степень клинических расстройств при острой интоксикации этанолом, является его концентрация в плазме крови (табл. 3).
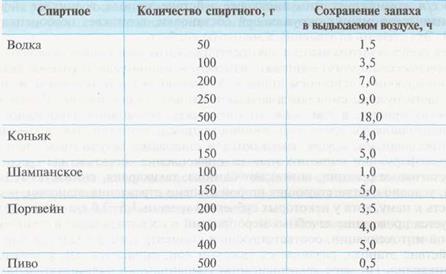
Легочный путь экскреции этанола незначителен и составляет 0,05% его уровня в плазме крови. Однако он имеет значение с точки зрения диагностики алкогольного опьянения. Считается, что порог ощущения запаха алкоголя в выдыхаемом воздухе определяется при содержании этанола в крови не ниже 0,3 г/л, при увеличении этой концентрации до 1,2 г/л запах ощущается у всех людей. При высокой температуре окружающей среды обонятельный порог понижается, а при низкой - повышается. Сохранение запаха зависит от количества выпитого и может косвенно указывать на давность приема спиртного. В табл. 4 приведены данные сохранения запаха спиртного в выдыхаемом воздухе в зависимости от количества выпитого.
Медицинское освидетельствование на состояние опьянения лица, которое управляет транспортным средством, проводится в организациях здравоохранения, имеющих лицензию на осуществление медицинской деятельности с указанием соответствующих работ и услуг. Освидетельствование проводится на основании протокола о направлении на освидетельствование, подписании должностным лицом, которому предоставлено право государственного надзора и контроля за безопасностью движения и эксплуатации транспортного средства.
Основой заключения о состоянии освидетельствуемого служат данные комплексного медицинского освидетельствования с учетом результатов лабораторных исследований.
Заключение о состоянии опьянения в результате употребления алкоголя выносится при наличии клинических признаков опьянения и положительных результатах определения алкоголя в
выдыхаемом воздухе при помощи одного из технических средств измерения, проведенного с интервалом 20 мин, или при применении не менее двух разных технических средств индикации на
наличие алкоголя в выдыхаемом воздухе с использованием их обоих при каждом исследовании,
проведенном с интервалом 20 мин.
В настоящее время для определения этанола используются методы, основанные на различных физико-химических принципах (табл. 7), обеспечивающие его надежную идентификацию и количественную или полуколичественную оценку. Оборудование, используемое при определении этанола, должно быть включено в Перечень разрешенных к применению медицинских изделий (изделия медицинского назначения и медицинской техники) для скрининговых исследований наличия алкоголя в организме человека или в Перечень приборов, разрешенных к применению в медицинской практике.
Иллюстративный материал
Таблица 1.
Марки и номера технической документации этиловых спиртов, производимых в РК


Рис. 1. Хроматограммы синтетического спирта-сырца (а) и пищевого ферментативного спирта-сырца (б).
а. 1 — диэтиловый эфир, 2 — ацетальдегид, 4 — оксид этилена, 8 — третичный бутанол, 9 — метилэтилке-
тон, 10 — диметоксиметан, 11 — вторичный бутанол, 12 — кротоновый альдегид, 14 — бензол, 15 изо-гексанол, 16 — метилизобутилкетон, 17 — н-пентанол (стандарт), 3, 5—7, 13 — не идентифицированы.
б. 1 — ацетальдегид, 2 — метилацетат, 3 — этилацетат, 4 — метанол, 5 — н. пропанол, 6 — изобутанол,
7 — изоамиловые спирты, 8 — н. пентанол (стандарт).
Таблица 2.
Влияние различных веществ на полноту абсорбции этанола и его концентрацию в плазме крови


Таблица 3.
Концентрация этанола в плазме крови и соответствующие ей клинические проявления

Таблица 4.
Сохранение запаха алкоголя в выдыхаемом воздухе
в зависимости от количества и состава спиртного
|
Таблица 5.
Отношение распределения этанола в тканях, органах
и биологических жидкостях к распределению в крови

|
Таблица 6.
Результаты экспертизы, требующие интерпретации


* Забор проб артериальной крови сложен и не используется в экспертной практике.
'* Промилле — одна тысячная доля какого-либо числа, обозначаемая знаком %о (одна десятая процента).
Таблица 7.
Методы определения этанола у живых лиц*


|

|
Литература
1. Калетина Н.И. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2008.
2. Плетенева Т.В. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2006.
3. Белова А.В. Руководство к практическим занятиям по токсикологической химии.- М.:
Медицина, 1976.
6. Контрольные вопросы (обратная связь)
1. Перечислите этапы схема экспертного исследования спиртов с целью определения вида
используемого при их изготовлении сырья?
2. Для чего необходимо знать особенности фармакокинетики этанола?
3. Перечислите основные пути биотрансформации этилового спирта в организме.
4. Что является основным критерием, отражающим степень клинических расстройств при острой интоксикации этанолом?
5.Где и на основании чего проводится медицинское освидетельствование на состояние опьянения лица, которое управляет транспортным средством?
Кредит № 8
Тема 1 - Вредные пары и газы. Оксид углерода. Токсичность. Токсикокинетика. Клиническая диагностика. Метод гипербарической оксигенации в комплексе методов дезинтоксикационной терапии.
Цель: ознакомить студентов с оксидом углерода, его токсичностью и методом дезинтоксикационной терапии.
Тезисы лекции
Оксид углерода (II) и некоторые другие вещества можно обнаружить и определить количественно непосредственно в биологическом материале. Из ядовитых газообразных веществ особый токсикологический и судебно-медицинский интерес представляет СО — оксид углерода (II).
Монооксид углерода (угарный газ) встречается везде, где существуют условия для неполного сгорания веществ, содержащих углерод. Он входит в состав многих промышленных газов (доменный, генераторный, коксовый); содержание монооксида углерода в выхлопных газах двигателей внутреннего сгорания колеблется в пределах от 1 до 13 %. Долгосрочные последствия отравления угарным газом нередко приводят к летальному исходу. Исследователи обнаружили, что угарный газ повреждает белок миелин, входящий в состав оболочки нервных клеток. В ответ на отравление СО в организме начинается синтез специализированных лимфоцитов, которые выводят поврежденный белок из организма. Проблема заключается в том, что с удалением измененных молекул миелина одновременно повреждаются и нормальные молекулы, тем самым запускается своего рода цепная аутоиммунная реакция.
Оксид углерода (II) — бесцветный газ без запаха и вкуса. В воде почти не растворяется, горит синеватым пламенем до образования оксида углерода (IV) с выделением тепла. Острые отравления окисью углерода занимают ведущее место среди ингаляционных отравлений, летальные исходы составляют 12,5% общего количества всех смертельных отравлений.
Единственным путем поступления в организм СО являются дыхательные пути. Токсический эффект для человека наблюдается при вдыхании воздуха с концентрацией СО 3∙10-3 г/л в течение 1 ч. Механизм токсического действия СО обусловлен образованием карбоксигемоглобина — НЬСО. При острых отравлениях СО связывается преимущественно железом гемоглобина эритроцитов. При повторных или хронических отравлениях в плазме крови увеличивается количество негемоглобинового железа за счет выхода его из тканей.
При отравлениях СО нарушается углеводный обмен. Установлена зависимость между тяжестью интоксикации угарным газом и содержанием глюкозы в мозге.
Оксид углерода выводится из организма в основном через дыхательные пути в течение нескольких часов. После прекращения вдыхания СО 60—70% яда выделяется у человека в течение 1-го часа; за 4 ч выделение составит 96% абсорбированной организмом дозы. В ничтожном количестве оксид углерода выделяется через кожу — около 0.007 мл/ч. несколько больше — через ЖКТ и почки. СО с мочой выводится в виде комплексного соединения с железом.
Лабораторная диагностика отравлений оксидом углерода заключается в определении НЬСО в крови. В то же время содержание НЬСО в крови, которое определяется при поступлении больного в стационар, не может служить надежным критерием установления тяжести состояния больных.
Лечебные мероприятия начинают с удаления пострадавшего из зоны с повышенной концентрацией монооксида углерода. В дальнейшем проводится специфическая и симптоматическая терапия. Гипербарическая оксигенация является специфической антидотной терапией при данной патологии, поскольку она позволяет значительно ускорить (в 10—15 раз) диссоциацию карбоксигемоглобина и увеличить количество кислорода, свободно растворенного в плазме.
Как правило, после сеанса состояние больных улучшается, они приходят в сознание, снижается артериальное давление, стабилизируются пульс и частота дыхания.
Метод гипербарической оксигенации (ГБО) нашел широкое применение для лечения острых экзогенных отравлений, поскольку при этой патологии встречаются все основные типы и формы гипоксии. При определении показаний к проведению ГБО первостепенное значение имеет стадия отравления. В токсикогенной стадии, когда токсичное вещество циркулирует в крови, ГБО может служить методом усиления естественных процессов детоксикации, но только в тех случаях, когда биотрансформация ядов происходит по типу окисления при непосредственном участии кислорода без образования более токсичных метаболитов (монооксид углерода, метгемоглобинобразующие вещества). Напротив, ГБО противопоказана в токсикогенной стадии отравлений ядами, биотрансформация которых протекает по типу окисления с летальным синтезом, что приводит к образованию более токсичных метаболитов (карбофос, этиленгликоль и т.д.).
Иллюстративный материал
Содержание оксида углерода (II) в крови определяют по количеству карбоксигемоглобина.
Поступивший в организм оксид углерода (II) связывается с дезокси- и оксигемоглобином, вследствие чего образуется карбоксигемоглобин (СОНЬ). Метгемоглобин не связывается с оксидом углерода (II) в крови. Однако в лабораторных условиях при помощи дитионита натрия (Na2S2O4-2H2O) или других восстановителей метгемоглобин можно перевести в дезоксигемоглобин.
В ряде источников литературы дитионит натрия встречается под названием «гидросульфит натрия».
Все перечисленные выше соединения гемоглобина (дезоксигемоглобин, оксигемоглобин и карбоксигемоглобин) можно обнаружить по их спектрам поглощения в видимой области в пределах длин волн от 450 до 620 нм. Спектры поглощения оксигемоглобина и карбоксигемоглобина незначительно отличаются друг от друга. В связи с этим спектральные характеристики указанных соединений трудно использовать для их количественного определения. Значительно отличаются друг от друга спектры поглощения дезоксигемоглобина и карбоксигемоглобина. Поэтому различие этих спектров используется для количественного определения карбоксигемоглобина в крови.

Рис. 1. Аппарат для насыщения крови оксидом углерода (II).
Литература
1. Токсикологическая химия: метаболизм и анализ токсикантов: учебное пособие + СD/ под ред. Н.И. Калетиной. – М., 2008. – 1016 с. Переплет.
2. Токсикологическая химия: учебник / под ред. Т.В. Плетеневой. – 2-ое изд. – М., 2008. – 512 с. Переплет.
3. Лужников Е.А. Клиническая токсикология /Е.А. Лужников.-М.,"Медицина", 1994. – 189 с.
4. Крамаренко В. Ф. Токсикологическая химия / В. Ф. Крамаренко. - Киев, «Высшая школа», 1989.- 272 с.
Контрольные вопросы (обратная связь)
1. Какие пути проникновения оксида углерода (II) в организм при отравлениях?
2. Что образуется при взаимодействии оксида углерода (Л) с гемоглобином.'
3. Что такое дезоксигемоглобин, оксигемоглобин и метгемоглобин и как они взаимодействуют с оксидом углерода ( II)?
4. Какие основные симптомы отравления оксидом углерода (II)?
5. При каком содержании карбоксигемоглобина в крови человека может наступить смерть?
Тема 2-3 - Методы обнаружения и количественного определения в крови карбоксигемоглобина.
Цель: Ознакомить студентов с методами обнаружения и количественного определения в крови карбоксигемоглобина.
Тезисы лекции
Для определения СО в крови можно использовать различные методы, включая предварительные пробы, спектрофотометрию, газовую хроматографию и специальные методы. Определение СО в крови проводят либо по СО, либо выделяют из пробы крови газобразную смесь СО, СО,. О,, N.. измеряют количество газа и тем или иным способом устанавливают содержание в нем оксида углерода (II).
Предварительные методы исследования (химические). При выполнении нижеуказанных реакций параллельно исследуют два образца — кровь, не содержащую НЬСО и кровь пострадавшего при отравлении. В образцы добавляют одинаковые объемы реактивов и наблюдают за изменением окраски. Изменение окраски происходит только в образцах с нормальной кровью. Окраска образцов крови пострадавшего при отравлении не изменяется или изменяется незначительно.
Экспресс-тесты, или пробы, проводят непосредственно на месте происшествия или сразу после поступления пострадавшего в клинику. Цель — быстро установить наличие НЬСО.
Спектроскопический метод. В основу спектроскопического (микроспектрального) анализа положено свойство гемоглобина и его производных поглощать свет определенной длины волны, поэтому при прохождении луча света через растворы, содержащие гемоглобин пли его производные, в спектре появляются темные полосы поглощения, расположенные в определенной части спектра для каждого производного гемоглобина. Спектральный метод оправдывает себя при исследовании крови, содержащей 10—30 % карбоксигемоглобина. В судебно-медицинской практике для этого пользуются микроспектроскопами — приборами, представляющими собой спектроскоп, соединенный с окуляром. Оксигемоглобин (НЬО) имеет в видимой части спектра две полосы поглощения при λ 589— 577 и λ556—536 нм, восстановленный гемоглобин (НЬ) имеет одну полосу поглощения при λ 596—543 нм, НЬСО — 2 полосы при λ579—564 и λ 536—523 нм.
Газохромотографический метод
Газовая хроматография является достаточно простым и прямым методом определения общего количества СО в крови. Высвобождение СО из НЬСО крови достигается обычно добавлением растворов натрия карбоната или некоторых других веществ. Газовая фаза вводится в хроматограф, снабженный детектором по теплопроводности. Концентрация СО определяется по калибровочному графику после расчета площади пика. Результаты метода достоверны при концентрации НЬСО 30—100%. Ошибка при использовании метода составляет 10%.
Смертельная концентрация НЬСО в крови составляет в среднем около 60%, но может колебаться от 40 до 80% и более, что обусловлено влиянием внешних условий и особенностями организма. При освидетельствовании лиц, перенесших отравление СО, нужно иметь в виду, что при интоксикации средней степени в течение первого часа выделяется около половины поступившего в организм СО. Полное освобождение организма от СО наступает спустя 10—12 ч, но может затягиваться и до 24 ч. При обнаружении в крови трупа менее 60% НЬСО необходимо проанализировать патологоанагомические данные и обстоятельства отравления, чтобы обосновать заключение о причине смерти.
Иллюстративный материал
1. Таблица 1 Зависимость симптомов отравления от количества карбоксигемоглобина в крови

Рисунок 1.
Для количественного спектрофотометрического определения оксида углерода (II) по карбоксигемоглобину приготовляют ряд растворов.
Аппарат для насыщения крови оксидом углерода (II).

Рисунок 2. Спектр поглощения карбоксигемоглобина (I) и дезоксигемоглобина (II).

Литература
1. Токсикологическая химия: метаболизм и анализ токсикантов: учебное пособие + СD/ под ред. Н.И. Калетиной. – М., 2008. – 1016 с. Переплет.
2. Токсикологическая химия: учебник / под ред. Т.В. Плетеневой. – 2-ое изд. – М., 2008. – 512 с. Переплет.
3. Лужников Е.А. Клиническая токсикология /Е.А. Лужников.-М.,"Медицина", 1994. – 189 с.
4. Крамаренко В. Ф. Токсикологическая химия / В. Ф. Крамаренко. - Киев, «Высшая школа», 1989.- 272 с.
Контрольные вопросы (обратная связь)
1. Классификация методов обнаружения и количественного определения в крови карбоксигемоглобина.
2. Качественный анализ. Предварительные методы исследования (химические).
3. Химические экспресс-методы обнаружения в крови карбоксигемоглобина.
4. Физико-химические методы исследования карбоксигемоглобина в крови.