Билет № 17
1. Методика организации химической олимпиады. Требования к комплекту заданий.
Организация химических олимпиад: от простого к сложному
Положение о Всероссийской олимпиаде школьников от 2007 года
предусматривает четыре этапа химической олимпиады: школьный,
муниципальный, региональный и заключительный.
Каждый этап состоит из нескольких туров: одного или двух теоретических и
экспериментального.
Не достаточно просто разработать комплекты заданий. Олимпиада любого
уровня –это результат долгой, кропотливой работы многих людей, поэтому
организации каждого этапа нужно уделять должное внимание.
Подготовительная, основная и заключительная стадии организации олимпиад
Подготовительная стадия.
Первый этап олимпиады –это школьный тур. Привлекать ребят к школьной олимпиаде нужно по принципу добровольности. Для возникновения интереса к олимпиаде можно создать выставку научно-популярной и учебной дополнительной литературы. При наличии дополнительных занятий и факультативов нужно разбирать на них варианты олимпиадных заданий, если дополнительных занятий нет, необходимо провести 1-2 занятия для тех, кто собирается участвовать в олимпиаде: ознакомить с целями олимпиады, регламентом проведения, с примерами заданий.
Очному туру может предшествовать проведение заочной олимпиады.
Преимущества заочного тура: 1) стимулирование учащихся к самостоятельной работе, чтению популярной литературы, предоставление возможности выйти за рамки учебника, расширить кругозор; 2) возможность решать задания в удобное время и в менее жесткие, чем на очном туре, временные рамки; 3) расширение разнообразия форм организации деятельности –доклады, рефераты, проведение экспериментов.
Число заданий в школьном туре может быть больше, чем на других этапах
(более шести). Уровень сложности заданий в школьном этапе должен быть
доступен для большинства ребят, но задания должны отличаться от контрольной работы необычностью постановки вопроса, носить занимательный характер, для решений предполагается применение нестандартных приемов.
Основная стадия.
Школьный этап олимпиады проводится после уроков. Школьники садятся так, чтобы вместе не сидели ребята из одного класса.На теоретический тур отводится не более 4 астрономических часов.
Центральная методическая комиссия рекомендует проводить в школьном
этапе экспериментальный тур. Если это невозможно, то в комплект заданий
нужно включать задачу, требующую мысленного эксперимента.
Призеры и победители школьного этапа определяются порезультатам,
сведенным в ранжированные таблицы по параллелям (по мере убывания
количества баллов). Участники, набравшие менее половины от максимального количества баллов, не могут являться победителями и призерами.Олимпиада по химии –это интеллектуальный форум, а не спортивное соревнование, поэтому допускается несколько первых, вторых и третьих мест.
Заключительная стадия.
С целью повышения эффективности школьного тура целесообразно
провести разбор заданий, решений и анализ допущенных ошибок
и неточностей. Учитель составляет отчет, к которому прилагает: списки
учащихся, отобранных на муниципальный этап; сводные ведомости результатов по каждому классу; условия, решения и система оценивания задач, по которым проводился школьный этап.
Установлено, что наиболее важными элементами химических
способностей учащихся являются (в порядке убывания):
1)устойчивость внимания;
2)хорошая переключаемость внимания;
3)объём внимания;
4)логическое и ассоциативное мышление;
5)концентрация внимания;
6)творческое воображение;
7)ассоциативная память;
8)пространственные представления;
9)логическое запоминание;
10)наблюдательность.
Таким образом, желая выявить потенциальных химиков, мы должны предложить на школьном этапе олимпиады как можно более широкое по компонентам способностей задание. Каждая из задач комплекта должна содержать «зонды» на компоненты химических способностей, а весь комплект в целом должен полностью перекрывать весь диапазон компонентов.
При разработке комплекта заданий школьной химической
олимпиады необходимо учитывать и ещё одно важное обстоятельство.
Среди её участников всегда присутствует некоторое количество
слабых учащихся, которым задание оказывается не под силу.
Понятно, что школьник, не справившийся ни с одной из задач,
получает психологическую травму и может надолго потерять веру в свои силы и возможности. Такой результат крайне нежелателен и его необходимо избегать. Поэтому в задание обязательно должны быть включены одна-две очень простые, так называемые «утешительные» задачи.
С другой стороны, полезно включать в олимпиадное задание одну сложную «дифференцирующую» задачу, доступную только хорошо подготовленным ученикам.
Задачи, используемых в олимпиадных комплектах, подразделяются на: качественные и расчетные (количественные), кроме того задачи бывают комбинированные.
Качественные задачи:
·Объяснение экспериментальных фактов;
·Распознавание веществ;
·Получение новых соединений;
·Предсказание свойств веществ, возможности протекания реакции, описание, объяснение явлений;
·Разделение смеси веществ.
Количественные задачи:
·Расчеты состава смеси (массовый, объемный и мольный проценты);
·Расчеты состава раствора (способы выражения концентрации, приготовление растворов заданной концентрации);
·Расчеты с использованием газовых законов (закон Авогадро, уравнение Клайперона-Менделеева); выведение химической формулы вещества;
·Расчеты по химическим уравнениям (стехиометрические соотношения);
·Расчеты с использованием законов химической термодинамики (закон
сохранения энергии, закон Гесса);
·Расчеты с использованием законов химической кинетики (закон
действующих масс, уравнение Аррениуса).
2. Формирование знаний о теории электролитической диссоциации веществ.
Теория электролитической диссоциации - одна из теоретических концепций школьного курса химии. Данная тема является логическим продолжением ранее изученного; следует учитывать запас знаний и умений учащихся, сформированных ранее и выступающих в роли опорных. К новым понятиям, формируемым в данной теме, относятся: понятия об электролитах (их делении на сильные и слабые в зависимости от степени диссоциации), об электролитической диссоциации, её сущности, механизмах, условиях; понятия о поведении ионов в растворе и реакциях между ними (реакции ионного обмена, гидролиз солей).
Все вещества делятся на 2 большие группы: электролиты и неэлектролиты.
Электролитами называются вещества (исключая металлы), растворы или расплавы которых проводят электрический ток. К электролитам относятся соединения, образованные ионными или ковалентными полярными связями. Это сложные вещества: соли, основания, кислоты, оксиды металлов (проводят электрический ток только в расплавах).
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. К ним относятся простые и сложные вещества, образованные малополярными или неполярными ковалентными связями.
Здесь можно привести опыт:
1. Берем прибор для определения электропроводности, который представляет собой: электрическую цепь, состоящую из последовательно соединенных источника тока, эбонитовой пластинки и смонтированных в пластинку угольных электродов, а так же лампочки.
2. Сначала электроды помещают в H2O, затем в сухой хлорид натрия и, наконец, в раствор хлорида натрия.
3. Лампочка загорается только в случае раствора хлорида натрия, который является проводником электрического тока.
Свойства растворов и расплавов электролитов впервые объяснил в конце XIXвека шведский учёный Сванте Аррениус, создав теорию электролитической диссоциации, основные положения которой следующие (электролитическая диссоциация – процесс распада электролита на ионы):
1. Молекулы (или формульные единицы) электролитов в растворах или расплавах распадаются на положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. Общая сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов, поэтому растворы или расплавы электролитов в целом остаются электронейтральными. Ионы могут быть как простые, состоящие только из одного атома (Na+,Cu2+,Cl–,S2-), так и сложные, состоящие из атомов нескольких элементов (SO42–,PO43–,NH4+, [Al(OH)4]–).
Простые ионы по своим физическим, химическим и физиологическим свойствам существенно отличаются от нейтральных атомов, из которых они образовались. В первую очередь, ионы являются гораздо более устойчивыми частицами, чем нейтральные атомы, и могут существовать в растворах или расплавах неограниченно долгое время, не вступая в необратимое взаимодействие с окружающей средой.
Такое различие в свойствах атомов и ионов одного и того же элемента объясняется разным электронным строением этих частиц.
Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя.
Вещества, образованные полярными ковалентными связями, переходят в раствор в виде отдельных молекул, которые, как и молекулы Н2О, представляют собой диполи, например:

 ¾
¾  ®+ –
®+ –
В этом случае диполи Н2О, ориентируясь соответствующим образом вокруг растворенной молекулы электролита, вызывают в ней дальнейшую поляризацию ковалентной связи, а затем и её окончательный гетеролитический разрыв (рис. 29).
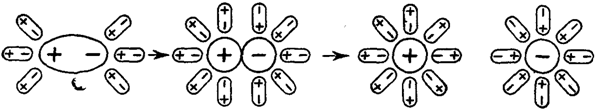
H–Cl®H++Cl
Рис. 29. Схема электролитической диссоциации в растворе полярной молекулыHCl
Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О).
Приводим объяснение механизма диссоциации веществ (с помощью картинок, анимаций):
· На примере строения воды: Вода имеет угловое строение. Связи O-H полярные, общая электронная пара смещена к наиболее электроотрицательно атому кислорода. Т.о. H2O полярна, т.е. представляет собой диполь – частицу с 2-мя полюсами.
· Дальше переходим к хлориду натрия. На анимации изображена кристаллическая решетка NaCl, далее происходит присоединение диполей H2O так, что положительные полюса идут к Cl-, а отрицательные полюса к Na+. Связь между ионами кристалла ослабляется, в-во переходит в раствор в виде гидратированных ионов.
· Тоже самое объясняет с ковалентной связью, на примере, HCl.
2. Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами ), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами ).
Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т.к. проводят электрический ток за счёт направленного движения электронов.
3. Процесс электролитической диссоциации обратим. Наряду с распадом молекул на ионы всегда протекает обратный процесс – соединение ионов в молекулы или ассоциация. Поэтому в уравнениях реакций электролитической диссоциации веществ вместо знака равенства «=» ставят знак обратимости « », например:
», например:
HF  H+ + F–
H+ + F–
CH3COOH  CH3COO– + H+
CH3COO– + H+
Одни электролиты в растворах полностью распадаются на ионы – это сильные электролиты .
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде – это слабые электролиты.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В тоже время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Количественно процесс распада молекул электролита на ионы оценивается с помощью степени электролитической диссоциации α (измеряется в долях %).
Степень электролитической диссоциации – это величина, которая показывает отношение числа распавшихся на ионы молекул вещества к общему числу его молекул в растворе (распавшихся и нераспавшихся):

NО=NД+NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N) и их химическое количество (n) связаны между собой соотношениемN=n∙NA, то степень диссоциации можно ещё рассчитать и другим способом:

В зависимости от степени диссоциации электролиты подразделяются на:
· Сильные (α ˃ 0,3) – в растворе практически нет молекул, есть только ионы (степень диссоциации значительно близка к 1).
Примеры: кислоты HNO3,H2SO4, HCl, HBr, HI, HClO4, щелочи KOH, NaOH, Ba(OH)2, Ca(OH)2, все растворимые соли.
· Средней силы (0,03 ˂ α ˂0,3) – в растворе есть и молекулы и ионы.
Примеры: кислоты H2SO3, H3PO4, HF.
· Слабые (0 ˂ α ˂0,03)– в растворе есть и молекулы и ионы (степень диссоциации значительно меньше 1).
Примеры: кислотыH2S, H2CO3, H2SiO4, CH3COOH, водаH2O, основания не растворимые в воде NH4OH.
Билет № 3
1. Виды содержания. Структура курса химии (профильный уровень).
Содержание химического образования – наиболее общая дидактическая категория, отражающая знания, способы деятельности, опыт творчества, ценностные отношения (к труду, наукам, образованию, материальной и духовной культуре, природе, обществу человеку, здоровью), необходимые для химического образования и самообразования.
Обучение химии в профильных классах ставит следующие цели:
• изучение основ химии – важнейших понятий, законов, теорий и методов химической науки во взаимосвязи с профильными предметами;
• формирование у учащихся целостной системы химических знаний как компонента единой естественно-научной картины мира;
• развитие мышления учащихся, формирование умений самостоятельно приобретать и комплексно применять знания по химии для объяснения наблюдаемых явлений и закономерностей;
• формирование познавательного интереса к химии как к одной из естественных наук, развитие творческих способностей учащихся и осознанных мотивов к изучению химии.
Адаптируя химическое содержание к различным профилям, следует конструировать его на основе двух компонентов: инвариантного ядра и вариативной составляющей. Инвариантное ядро содержания включает химический язык, основные химические понятия, законы, теории, факты и методы исследования, используемые в химии. Вариативная составляющая содержания должна отражать специфику профиля, устанавливать и иллюстрировать взаимосвязи химического содержания с содержанием профильных дисциплин.
В структуре содержания школьного курса химии имеются различные виды знаний, так называемые дидактические единицы (см. табл. 4.4.1).
Дидактическая единица– порция, доза химической информации, подлежащая усвоению учащимся за определенный период учебного времени. Нами рекомендуется 7 дидактических единиц.
Таблица 4.4.1
Дидактические единицы в структуре содержания обучения химии
| Дидактические единицы | Примеры |
| 1. Законы | Периодический закон |
| 2. Теории | Теория электролитической диссоциации |
| 3. Понятия | Химический элемент, вещество, химическая реакция, химическая технология, химическое производство |
| 4. Язык | символика, терминология, номенклатура |
| 5. Методы | химический эксперимент, наблюдение химических объектов, моделирование химических объектов |
| 6. Научные факты | состав, строение и свойства веществ, их получение, применение, нахождение в природе |
| 7. Вклад выдающихся ученых в науку | М. В. Ломоносов: в химическую науку – атомно-молекулярное учение, в педагогическую науку– роль и значение слова, химического эксперимента, междисциплинарных связей, количественных методов в преподавании химии |
К дидактическим единицам в структуре содержания школьного курса химии относят химические законы и теории, понятия, научные факты, методы химической науки, химический язык, вклад ученых в науку (химическую, педагогическую, ди-
дактическую). Все дидактические единицы находятся в целостной взаимосвязи и взаимодействии.При построении школьного курса химии и отборе содержания химического образования руководствуются определенными дидактическими принципами, адекватными закономерностям химико-образовательного процесса. В качестве ведущих дидактических принципов отбора содержания и построения
школьного курса химии следует отметить следующие.
1. Принцип научностипредусматривает соответствие содержания химического образования основам химической науки, современному ее состоянию и уровню ее развития.
2. Принцип стандартизациипредусматривает соответствие содержания
современным отечественным и мировым образовательным моделям, нормативам и измерителям.
3. Принцип оптимальности предполагает соответствие химической науке, международному стандарту образования, школьным условиям, учебному времени, учебным возможностям и возрастным особенностям учащихся.
4. Принцип историзмапредполагает раскрытие знаний, учебных проблем в трех аспектах (ретроспективном, современном, перспективном) и достижений науки как результата длительного ее исторического пути.
5. Принцип интеграции (и дифференциации)предполагает целостное объединение разобщенных ранее разнородных и однородных компонентов (с дальнейшим отчленением нового образования).
6. Принцип инновацийпредполагает введение новых идей, понятий, законов, теорий при отборе содержания; реализацию новых действий, средств, методов и
способов деятельности.
7. Принцип ведущей роли теорийпредполагает по возможности ранее изучение теорий сцелью оптимальной реализации их объяснительной, обобщающей и прогностической функций.
8. Принцип разделения трудностей предполагает равномерное распределение ведущих концептуальных теорий по учебным годам обучения, приближение теорий к началу курсов.
9. Принцип развития химических понятий предполагает преемственное раскрытие и расширение объема и содержания их посредством методов углубления, конкретизации, обобщения, систематизации и интеграции.
10. Принцип целостностипредполагает системную связь и взаимосвязь всех компонентов и дидактических единиц содержания, реализацию не только содержательно-логических, но и структурно-функциональных связей на основе научных теорий и ведущих идей.