
Пусть плоские слои жидкости, находящиеся на расстоянии ∆х, движутся со скоростями v1 и v2 (рис. 10.15). Тогда нижний слой будет ускорять движение среднего слоя, а верхний слой — замедлять его. В результате под действием сил внутреннего трения средний слой будет двигаться со скоростью v, большей v1, но меньшей v2.
При равномерном изменении скоростей движения слоев в направлении х значение grad v будет во всех точках среды одинаково и численно равно (v2—v1)/∆x, или ∆v/∆x.
Ньютон показал, что сила внутреннего трения, действующая на средний слой, прямо пропорциональна градиенту скорости я площади поверхности слоя ∆S. Математически закон Ньютона для внутреннего трения выражается формулой:

Величина η, выражающая зависимость силы внутреннего трения от рода вещества и от внешних условий, называется динамической вязкостью среды. Выведем единицу динамической вязкости η:

В СИ за единицу η принимается вязкость такой среды, в которой на площадь слоя в 1 м2 действует сила внутреннего трения в 1Н при градиенте скорости, равном 1 с-1. Вязкость среды зависит от ее температуры. Интересно отметить, что у газов она при нагревании возрастает, а у жидкостей уменьшается. Это указывает на то, что природа внутреннего трения в газах и жидкостях различна.

Вязкость газов обусловлена перелетом молекул из слоя в слой в результате их хаотического движения, которое они совершают помимо направленного движения со своим слоем. При этом молекулы, залетающие из нижнего слоя в средний (рис. 10.15), ускоряют его движение, а молекулы, залетающие из верхнего слоя в средний, замедляют его движение. Так как при повышении температуры скорость хаотического движения молекул возрастает, то вязкость газов увеличивается при нагревании.
В жидкостях переход молекул из слоя в слой тоже имеет место, но главной причиной вязкости жидкости являются силы взаимного притяжения ее молекул. Так как при нагревании жидкости расширяются, то силы взаимного притяжения их молекул при этом уменьшаются, чем и объясняется уменьшение вязкости жидкостей при повышении температуры. Например, вязкость воды при 0°С равна 17,75-10-4 Па*с, а при 90°С составляет 3,20*10-4 Па*с.
В 1840 г. французский ученый Л. Пуазейль показал, что объем жидкости, вытекающей через трубу при ламинарном течении, пропорционален четвертой степени радиуса трубы. В настоящее время формулу Пуазейля записывают в следующем виде:
V=(πr8/9lη)(p1-p2)t
Здесь V — объем жидкости, вытекающей через трубу с радиусом r и длиной l за время t при разности давлений в начале и в конце трубы ∆р=р1—р2. Формула (10.8) позволяет сравнивать вязкости различных жидкостей, протекающих через одну и ту же трубу, с помощью прибора, называемого вискозиметром.
Теплопроводность
Теплопроводность — это вид теплопередачи, при котором происходит непосредственная передача энергии от частиц (молекул, атомов) более нагретой части тела к частицам его менее нагретой части.
Рассмотрим ряд опытов с нагревом твердого тела, жидкости и газа.
Закрепим в штативе толстую медную проволоку, а к проволоке прикрепим воском или пластилином несколько гвоздиков. При нагревании свободного конца проволоки в пламени спиртовки воск плавится, и гвоздики постепенно отпадают от проволоки. Причем сначала отпадают те, что находятся ближе к пламени, затем по очереди все остальные. Объясняется это следующим образом. Сначала увеличивается скорость движения тех частиц металла, которые находятся ближе к пламени. Температура проволоки в этом месте повышается. При взаимодействии этих частиц с соседними скорость последних также увеличивается, в результате чего повышается температура следующей части проволоки. Затем увеличивается скорость движения следующих частиц и т. д., пока не прогреется вся проволока.
Следует помнить, что при теплопроводности само вещество не перемещается вдоль тела, переносится лишь энергия.
Рассмотрим теперь теплопроводность жидкостей. Возьмем пробирку с водой. Положим в нее кусочек льда и станем нагревать верхнюю часть пробирки. Вода у поверхности скоро закипит. Лед же на дне пробирки за это время почти не растает. Значит, у жидкостей теплопроводность невелика, за исключением ртути и жидких металлов.
Это объясняется тем, что в жидкостях молекулы расположены на больших расстояниях друг от друга, чем в твердых телах.
Исследуем теплопроводность газов. Сухую пробирку наденем на палец и нагреем в пламени спиртовки донышко. Палец при этом долго не чувствует тепла.
Это связано с тем, что расстояние между молекулами газа еще больше, чем у жидкостей и твердых тел. Следовательно, теплопроводность газов еще меньше.
Итак, теплопроводность различных веществ различна.
Наибольшей теплопроводностью обладают металлы, особенно серебро и медь. Если теплопроводность различных веществ сравнивать с теплопроводностью меди, то окажется, что у железа она меньше примерно в 5 раз, у воды — в 658 раз, у пористого кирпича — в 848 раз, у свежевыпав-шего снега — почти в 4000 раз, у ваты, древесных опилок и овечьей шерсти — почти в 10 ООО раз, а у воздуха она меньше примерно в 20 000 раз. Плохой теплопроводностью обладают также волосы, перья, бумага, пробка и другие пористые тела. Это связано с тем, что между волокнами этих веществ содержится воздух. Самой низкой теплопроводностью обладает вакуум (освобожденное от воздуха пространство). Объясняется это тем, что теплопроводность — это перенос энергии от одной части тела к другой, который происходит при взаимодействии молекул или других частиц. В пространстве, где нет частиц, теплопроводность осуществляться не может.
Если возникает необходимость предохранить тело от охлаждения или нагревания, то применяют вещества с малой теплопроводностью. Так, ручки для кастрюль, сковородок изготавливают из пластмассы. Дома строят из бревен или кирпича, обладающих плохой теплопроводностью, а значит, предохраняют помещения от охлаждения. На применении вакуума в качестве теплоизоляционного «материала» основано устройство термоса, или сосуда Дьюара, который был изобретен в 1892 г. английским ученым Джеймсом Дьюаром.
В 1807 году французский ученый Фурье доказал экспериментально, что во всякой точке тела (вещества) в процессе теплопроводности присуща однозначная взаимосвязь между тепловым потоком и градиентомтемпературы:
 ,
,
где Q – тепловой поток, выражается в Вт;
grad(T) – градиент температурного поля (совокупности числовых значений температуры в разнообразных местах системы в выбранный момент времени), единицы измерения К/м;
S – площадь поверхности теплообмена, м2;
λ – коэффициент теплопроводности, Вт/(м К).
Градиент температуры получится характеризовать в виде векторнойсуммы составляющих по осям декартовых координат:
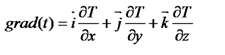
где i, j, k – ортогональные между собой единичные векторы, нацеленные по координатным осям.
Значит, данный закон устанавливает величину теплового потока при переносе тепла посредством теплопроводности.
Закон Фурье для поверхностной плотности теплового потока принимает вид:
 .
.
Знак «минус» обозначает, что векторы теплового потока и градиента температуры разнонаправленные. Следует понимать, что теплота передается в направлении спада температуры.
И все же не лишним будет указать, что закон Фурье не принимает в расчет инерционность процесса теплопроводности, иначе говоря, в представленной модели колебание температуры в любой точке мгновенно распространяется на всё тело. Закон Фурье некорректно применять для характеристики высокочастотных процессов таких как, к примеру, распространение ультразвука, ударной волны.
К явлениям переноса относятся теплопроводность, диффузия и вязкость. Ограничимся рассмотрением одномерных явлений переноса, когда перенос какой-либо величины происходит в одном направлении.
Проанализируем вначале макроскопический механизм этих явлений и описывающие их опытные закономерности.
1. Явление теплопроводности. В случае если в газе какие-либо внешние причины привели к возникновению неоднородности температуры, то молекулы газа в различных частях его объёма имеют различные значения кинœетической энергии хаотического движения. Молекулы, попавшие в результате хаотического движения из более нагретых областей газа в более холодные, при соударении с другими молекулами отдают им избыток кинœетической энергии. И наоборот, молекулы из более холодных областей газа, попадая в более нагретые, при столкновении увеличивают свою энергию. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, хаотическое тепловое движение молекул приводит к направленному переносу тепловой энергии от горячих областей газа к холодным.
Явление теплопроводности описывается уравнением Фурье:
 . .
| (8.31) |
Здесь dQ – количество теплоты, переносимой через площадку S за время dt;  – градиент температуры, а k (каппа) – коэффициент теплопроводности. Знак "–" в (8.31) означает, что теплота переносится в сторону убыли температуры. В случае если в формуле (8.31) положить S=1, dt=1,
– градиент температуры, а k (каппа) – коэффициент теплопроводности. Знак "–" в (8.31) означает, что теплота переносится в сторону убыли температуры. В случае если в формуле (8.31) положить S=1, dt=1, 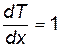 , то k=dQ, ᴛ.ᴇ. коэффициент теплопроводности численно равен количеству теплоты, переносимому через единичную площадку за единицу времени при градиенте температуры, равном единице. Единицы измерения коэффициента теплопроводности устанавливается на основании (8.31): [k]=Дж/(м×с×К).
, то k=dQ, ᴛ.ᴇ. коэффициент теплопроводности численно равен количеству теплоты, переносимому через единичную площадку за единицу времени при градиенте температуры, равном единице. Единицы измерения коэффициента теплопроводности устанавливается на основании (8.31): [k]=Дж/(м×с×К).
Явление диффузии. Диффузией принято называть процесс установления внутри газа равновесного распределœения концентрации примесных молекул.
Будем считать, что концентрация базовых молекул n в данном объёме газа всюду постоянна, в то время как концентрация примесных молекул n0 распределœена по объёму неравномерно.
Процесс диффузии вызван хаотическим тепловым движением молекул, ĸᴏᴛᴏᴩᴏᴇ приводит к направленному переносу примесных молекул в сторону уменьшения их концентрации.
Явление диффузии описывается уравнением Фика
 . .
| (8.32) |
где dM – масса примеси, переносимая через площадку S за время dt; D – коэффициент диффузии, численно равный массе примеси, перенесенной через единичную площадку при dt=1 и  ;
;  – градиент плотности примесного газа; r0=m0n0 – плотность примесного газа (парциальная плотность); m0 – масса примесной молекулы.
– градиент плотности примесного газа; r0=m0n0 – плотность примесного газа (парциальная плотность); m0 – масса примесной молекулы.
Единицы измерения коэффициента диффузии [D]=м2/с.
3. Явление вязкости. Явление вязкости (или внутреннего трения) состоит в возникновении силы сопротивления между слоями газа, движущимися с различными скоростями. Это явление возникает в результате переноса импульса, соответствующего направленному движению молекул, от одного слоя к другому (рис. 8.10). На этом рисунке u 1 и u 2 – скорости направленного движения молекул в различных слоях. В результате переходов типа 1 "медленная" молекула попадает в слой с более быстрыми молекулами и в результате столкновений отбирает у них часть импульса. По этой причине скорость направленного движения u 2 уменьшается. При обратном переходе (переход 2) нижний слой убыстряется. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, в результате обмена импульсами скорости направленного движения выравниваются.
 Рис. 8.10. Рис. 8.10.
|
Явление вязкости описывается уравнением Ньютона (см. формулу (5.9)).
Умножая уравнение (5.9) на dt и замечая, что по второму закону Ньютона импульс силы Fdt равен изменению импульса dК, получаем
 . .
| (8.33) |
Тем самым уравнение вязкости приведено к виду, аналогичному (8.31) и (8.32). Эти уравнения можно объединить, записав
 . .
| (8.34) |
где смысл G, m и g зависит от того, какое из явлений переноса (теплопроводность, диффузия или вязкость) рассматривается (табл. 8.1).
Таблица 8.1
| Явление переноса | Макрохарактеристика dG | Коэффициент переноса m | Градиент 
| Микрохарактеристика a |
| Теплопроводность | dQ | k | 
| 
|
| Диффузия | dM | D | 
| m0 |
| Вязкость | dK | h | 
| mu |
23. Работа газа во время изменения объема. Внутренняя энергия термодинамической системы. Первый закон термодинамики, его применение к различных изопроцессах в газах
Если газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работу dA = Fdl = pS dl = pdV (рис. 9.1), т. е.
dA = pdV. (9.3)

Рис. 9.1
Полная работа A, совершаемая газом при изменении его объема от V 1 до V 2,
 . (9.4)
. (9.4)
Изменение давления газа при его расширении можно представить графически (рис. 9.2).

Рис. 9.2
При увеличении объема на dV совершаемая газом работа равна pdV,
т.е. определяется площадью заштрихованной полоски. Полная работа, совершаемая газом при расширении от объема V 1 до объема V 2определяется площадью, ограниченной осью абсцисс, кривой p (V) и прямыми V 1 и V 2.
Внутренняя энергия
Термодинамических систем
Тема 2 Энергетические характеристики
Внутренняя энергия  термодинамической системы представляет собой сумму всех видов энергии движения и взаимодействия частиц, составляющих систему.
термодинамической системы представляет собой сумму всех видов энергии движения и взаимодействия частиц, составляющих систему.
Это означает, что независимо от предыстории системы её энергия в данном состоянии имеет присущее этому состоянию значение, поэтому приращение внутренней энергии при переходе системы из одного состояния в другое всегда равно разности значений внутренней энергии в конечном и начальном состояниях независимо от пути перехода.
Таки образом,
 . (2.1)
. (2.1)
Внутренняя энергия является величиной аддитивной, т.е. внутренняя энергия системы равна сумме внутренних энергий отдельных ее частей.
В термодинамике часто используется понятие удельной внутренней энергии, т.е. внутренней энергии для массы системы равной 1кг.
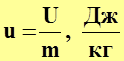 (2.2)
(2.2)
где  ¾ масса системы, кг.
¾ масса системы, кг.
Каждое тело имеет вполне определенную структуру, оно состоит из частиц, которые хаотически движутся и взаимодействуют друг с другом, поэтому любое тело обладает внутренней энергией. Внутренняя энергия — это величина, характеризующая собственное состояние тела, т. е. энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Внутренняя энергия одноатомного идеального газа определяется по формуле U=3/2 • т/М • RT.
Внутренняя энергия тела может изменяться только в результате его взаимодействия с другими телами. Существуют два способа изменения внутренней энергии: теплопередача и совершение механической работы (например, нагревание при трении или при сжатии, охлаждение при расширении).
Теплопередача — это изменение внутренней энергии без совершения работы: энергия передается от более нагретых тел к менее нагретым. Теплопередача бывает трех видов: теплопроводность (непосредственный обмен энергией между хаотически движущимися частицами взаимодействующих тел или частей одного и того же тела); конвекция (перенос энергии потоками жидкости или газа) и излучение (перенос энергии электромагнитными волнами). Мерой переданной энергии при теплопередаче является количество теплоты (Q).
Эти способы количественно объединены в закон сохранения энергии, который для тепловых процессов читается так. Изменение внутренней энергии замкнутой системы равно сумме количества теплоты, переданной системе, и работы, внешних сил, совершенной над системой. D U= Q + А, где D U— изменение внутренней энергии, Q — количество теплоты, переданной системе, А — работа внешних сил. Если система сама совершает работу, то ее условно обозначают А'. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так: Q = Α' + D U, т. е. количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии.
При изобарном нагревании газ совершает работу над внешними силами Α' = p(V1-V2) = pΔV, где
V1, и V2 — начальный и конечный объем газа. Если процесс не является изобарным, величина работы может быть определена площадью фигуры, заключенной между линией, выражающей зависимость p(V) и начальным и конечным объемом газа (рис. 13).
Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом.

В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: Q = А', т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется.
В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: Q = D U + А'.
При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е., А = О, и уравнение первого закона имеет вид:
Q = D U, т. е. переданное количество теплоты идет на увеличение внутренней энергии газа.
Адиабатным называют процесс, протекающий без теплообмена с окружающей средой. Q = 0, следовательно, газ при расширении совершает работу за счет уменьшения его внутренней энергии, следовательно, газ охлаждается, Α' = D U. Кривая, изображающая адиабатный процесс, называется адиабатой.
24. Теплоёмкости идеального газа. Ср и Сv. Работа газа различных изопроцессах. Адиабатический процесс. Уравнение Пуасонна.
Отношение количества теплоты 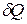 , полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела
, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела  , называется теплоемкостью тела в данном процессе:
, называется теплоемкостью тела в данном процессе:
 .
.
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
удельную массовую теплоемкость c, отнесенную к 1 кг газа,
Дж/(кг·К);
удельную объемную теплоемкость c´, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К);
удельную мольную теплоемкость  , отнесенную к одному киломолю, Дж/(кмоль·К).
, отнесенную к одному киломолю, Дж/(кмоль·К).
Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями:  ;
; 
Здесь  — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от +∞ до -∞.
В термодинамических расчетах большое значение имеют:
теплоемкость при постоянном давлении
 ,
,
равная отношению количества теплоты  , сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
теплоемкость при постоянном объеме
 , (1.5)
, (1.5)
равная отношению количества теплоты, подведенной к телу в процессе при постоянном объеме, к изменению температуры тела.
В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы  , и
, и
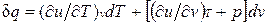 .
.
Для изохорного процесса (v =const) это уравнение принимает вид  , и, учитывая (1.5), получаем, что
, и, учитывая (1.5), получаем, что
 ,
,
т. е. теплоемкость тела при постоянном объеме равна частной производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры.
Для идеального газа 

Для изобарного процесса () из уравнения (2.16) и (2.14) получаем

или

Это уравнение показывает связь между теплоемкостями ср и сv. Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому  и, кроме того, из уравнения состояния следует
и, кроме того, из уравнения состояния следует  , откуда
, откуда
 .
.
Это соотношение называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов.
В процессе v =const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы.
Для реальных газов  , поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
, поскольку при их расширении (при p =const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики.
Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа
 ,
,
где Nо — число Авогадро; i — число степеней свободы (число независимых координат, которые нужно задать для того, чтобы полностью определить положение молекулы в пространстве).
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси, соединяющей атомы, равна нулю, если атомы считать точками). Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных.
Поскольку для идеального газа 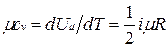 , то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
, то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
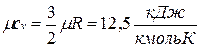 ;
;  ;
;  .
.
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур (табл. 2.1), однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
Теплоемкость некоторых газов при t= 0°С в идеально-газовом состоянии
| Газ | Число степеней свободы | Мольная теплоемкость, кДж/кмольК | k = ср /сv |
| Гелий Не | 12,60 | 1,660 | |
| Аргон Аг | 12,48 | 1,660 | |
| Кислород 02 | 20,96 | 1,397 | |
| Водород Н2 | 20,30 | 1,410 | |
| Азот М2 | 20,80 | 1,400 | |
| Метан СН4 | 26,42 | 1,315 | |
| Аммиак ЫН3 | 26,67 | 1,313 | |
| Диоксид угле- рода СО2 | 27,55 | 1,302 |
Эта теория устанавливает, прежде всего, несправедливость теоремы о равномерном распределении энергии по степени свободы в области низких и высоких температур. С уменьшением температуры газа происходит «вымораживание» числа степеней свободы молекулы. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Теплоемкость реального газа зависит от давления, правда, очень слабо.
Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
Средней теплоемкостью с ср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:

Выражение
 *
*
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость. Из * следует, что

поэтому
 .
.
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
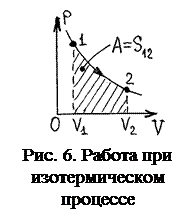 Вычислим работу идеального газа при различных изопроцессах в соответствии с её определением
Вычислим работу идеального газа при различных изопроцессах в соответствии с её определением
А =  . (5)
. (5)
1. Изотермический процесс.
Подставив в (5) выражение р из уравнения pV= ν RT 0, получаем:
 .
.
 2. Изохорный процесс. Так как здесь V =const, то А =0.
2. Изохорный процесс. Так как здесь V =const, то А =0.
3. Изобарный процесс. Так как здесь р =const= р 0, то  .
.
4. Адиабатный процесс.
Так как здесь Q =0. то работа газа совершается только за счёт его внутренней энергии:
А = Q −Δ U =−Δ U =−ν CV Δ T =ν CV (Т 1− Т 2). (6)
Отсюда видно, что при адиабатном расширении, когда А = p Δ V >0, газ охлаждается, т.е. Δ Т <0.
Если в формулу (6) подставить Т 2 из уравнения адиабаты T 1 V 1γ−1= T 2 V 2γ−1, то получим ещё одно выражение для работы газа при адиабатном процессе:
А =ν СVТ 1(1−(V 1/ V 2)γ−1) (получить самостоятельно).
Имеется два существенно различных вида воздействия, которые приводят к изменению состояния системы, ᴛ.ᴇ. к изменению термодинамических параметром: давления, объёма и температуры. Одно из них – совершение работы.
В термодинамики рассматривается перемещение частей макроскопического тела друг относительно друга. При совершении работы изменяется объём тела, скорость тела остается равной нулю, но скорость молекул газа меняется. Меняется и температура газа.
 – работа газа при изобарном процессе
– работа газа при изобарном процессе
 – изменение объёма
– изменение объёма
При рассмотрении  газ совершает работу, отдает энергию окружающим телам. В случае если
газ совершает работу, отдает энергию окружающим телам. В случае если  то над газом совершают работу, газ получает энергию.
то над газом совершают работу, газ получает энергию.
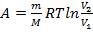 – работа газа при изотермическом процессе
– работа газа при изотермическом процессе
При изохорном процессе:  тогда А=0.
тогда А=0.


Работа͵ совершаемая газом численно равна площади под кривой, изображающей изменения состояние в диаграмме p,V.
4. Адиабатический процесс. Если сосуд с расширяющимся газом теплоизолировать от окружающей среды, то теплообмен будет отсутствовать, т. е. Q = 0. Процесс, происходящий при соблюдении этого условия, называется адиабатическим.
Уравнение первого начала термодинамики при учете условия Q = 0 принимает вид
0 = ΔU + A или A = – ΔU. (109)
Следовательно, при адиабатическом процессе работа совершается только за счет внутренней энергии газа. При адиабатическом расширении газ совершает работу, а его внутренняя энергия и, следовательно, температура падают. При адиабатическом сжатии работа газа отрицательна (внешняя среда производит работу над газом), внутренняя энергия и температура газа возрастают.
Адиабатический процесс можно реализовать практически и при отсутствии хорошей теплоизоляции. Но тогда необходимо вести процесс столь быстро, чтобы за время его осуществления не произошел сколько-нибудь существенный теплообмен с внешней средой.
Теплоемкость при адиабатическом процессе
 . (110)
. (110)
Выведем уравнение кривой, изображающей адиабатический процесс на рV- диаграмме. Уравнение состояния моля газа имеет вид
pV=RT. (111)
При бесконечно малом изменении состояния совершаемая работа А = pdV, а изменение внутренней энергии, согласно (83), Δ U –> CVdT. Подставляя эти значения A и ΔU в уравнение первого начала термодинамики (109), получим:
CVdT + pdV = 0. (112)
Это есть уравнение адиабаты в дифференциальной форме. Поскольку оно содержит все три параметра — р, V и Т, — то для исключения одного из них воспользуемся уравнением состояния (111), предварительно продифференцировав его:
pdV + Vdp = RdT. (113)
Умножая уравнение (112) на R, а (113) — на СV искладывая их, получим
(CV + R)pdV + CVVdp = 0. (114)
Принимая во внимание, что для идеального газа CV + R = = Ср, разделим уравнение (114) на произведение CVpV и введем обозначение
 . (115)
. (115)
Тогда (114) примет вид
 . (116)
. (116)
Учитывая, что постоянный множитель γ можно внести под знак дифференциала, преобразуем (116) к виду
d[γlnV + lnp] = 0. (117)
Отсюда следует, что величина, стоящая в скобках, должна быть постоянной. Обозначим эту константу как ln(const). Тогда
γlnV + lnp = ln(const). (118)
Учитывая, что γlnV = lnVγ и потенцируя выражение (118), получим
pVγ = const. (119)
Это и есть уравнение адиабаты. Его также называют уравнением Пуассона.
Поскольку γ > 1. то кривая, изображаемая этим уравнением (рис. 39), идет круче изотермы pV = const, которая для сравнения показана на том же чертеже штрих-пунктиром. Видно, что при адиабатическом расширении из точки I кривая (119) опускается ниже изотермы, т. е. газ охлаждается, а при адиабатическом сжатии кривая (119) поднимается выше изотермы, т. е. газ нагревается. Величина работы адиабатического процесса может быть особенно просто вычислена с помощью уравнения (109):
A = –CVΔT =–CV(T2 – T1) = CV(T1 – T2). (120)
Используя формулу (115), выражение (120) можно преобразовать к виду:
 (121)
(121)
Для нахождения же конечной температуры T2 можно, комбинируя (111) и (119), получить соотношение
TVγ–1 = const. (122)
Для одноатомного газа Cv = 12,5 кДж/(кмоль*К), СP = Cv + R = 20,8 кДж/(кмоль*К), и показатель степени адиабаты равен примерно 1,67. Для двухатомных газов при обычных температурах  . Для многоатомных газов при возбуждении их колебательных степеней свободы теплоемкости СP и Cv имеют еще большие значения и показатель степени адиабаты
. Для многоатомных газов при возбуждении их колебательных степеней свободы теплоемкости СP и Cv имеют еще большие значения и показатель степени адиабаты
 (123)
(123)
еще ближе к единице.
В быстроходных двигателях внутреннего сгорания и при истечении газов через сопла реактивных двигателей процесс расширения газа протекает настолько быстро, что его можно считать практически адиабатическим и рассчитывать по уравнению (119).

Рис. 39. Адиабата и изотерма
Так как у> 1, то из (122) следует, что при адиабатическом сжатии газ нагревается, а при адиабатическом расширении — охлаждается. Это явление находит применение в дизелях, где воспламенение горючей смеси осуществляется путем адиабатического сжатия. Нагревание газа при адиабатическом сжатии объясняется тем, что во время сжатия над газом производится работа, которая идет на увеличение его внутренней энергии. А так как внутренний энергия идеального газа зависит только от температуры, то это увеличение внутренней энергии проявляется в повышении его температуры. Аналогично объясняется и охлаждение газа при адиабатическом расширении. Охлаждение газа при адиабатическом расширении используется в холодильных машинах.
Уравнение Пуассона