КУРСОВАЯ РАБОТА
По дисциплине: Термодинамика.
..
(наименование учебной дисциплины согласно учебному плану)
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Тема: Определение расхода воздуха и изобарно-изотермического потенциала_____
______________ для системы каменный уголь – карбонат магния_________________
Автор: студент гр. ЭП-09 ____________________/Жадовцев С.А./
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: ___________________
ПРОВЕРИЛ:
Руководитель проекта: ассистент ______________________/Горленков Д.В. /
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2011 год
Аннотация
Топливо - это любой горючий материал, который, вступая в реакцию с кислородом, выделяет теплоту. На практике топливом считают только те вещества, которые воспламеняются при умеренной температуре, имеют высокую теплотворную способность и могут быть получены в достаточном количестве доступными средствами. Химическая реакция между горючими элементами и кислородом называется горением. В результате этого процесса из реагирующих компонентов образуются продукты реакции и выделяется теплота.
В данной курсовой работе рассчитан расход воздуха и изобарно-изотермический потенциал. Представлены теоретические сведения о горении топлива. Построена графическая зависимость энергии Гиббса от температуры.
В работе содержится 17 страниц, 2 рисунка, 4 таблицы.
Аbstract
The Fuel - any combustible material, which, enterring in reaction with oxygen, selects the heat. In practice, the fuel consider only that material, which flare up under moderate temperature, have high calorific ability and can be received in sufficient amount available facility. The Chemical reaction between combustible element and oxygen is identified the combustion. As a result this process from component are formed products to reactions and stands out the heat.
In given term paper is calculated consuption of the air and Gibbs thermodynamic potential. The theoretical information will Presented about combustion fuel. Built graphic dependency to energy Gibbs from the temperature.
In work is kept 17 pages, 2 drawings, 4 tables.
Содержание
| ВВЕДЕНИЕ | |
| 1 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 1.1 Основные свойства топлива | |
| 2 РАСЧЕТНАЯ ЧАСТЬ 2.1 Постановка задания курсовой работы | |
| 2.2 Определение расхода воздуха и объема продуктов сгорания | |
| 2.3 Определение изобарно-изотермического потенциала (энергии Гиббса) | |
| 2.4 Построение графика зависимости T=f(∆G) | |
| ЗАКЛЮЧЕНИЕ | |
| СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ |
ВВЕДЕНИЕ
Основной источник тепловой энергии для металлургических печей — топливо. Топливом называется вещество, которое при нагревании в присутствии кислорода активно окисляется (сгорает) с выделением значительного количества тепла. Наибольшее значение для промышленности имеет углеродистое топливо, хотя, кроме него, тепловая энергия может получаться также при окислении сульфидных минералов, элементарной серы, железа и др.
Углеродистое топливо бывает твердое, жидкое и газообразное. По происхождению топливо подразделяется на естественное (природное) топливо и искусственное (вторичное).
Металлургические печи предъявляют к качеству топлива повышенные требования, заключающиеся в основном в высокой его калорийности, высокой температуре горения и небольшом содержании золы. В отдельных типах печей выдвигаются дополнительные требования но качеству топлива. Для шахтных печен требуется прочное, кусковое топливо с достаточной пористостью. Отражательные печи, отапливаемые пылевидным углем, должны обеспечиваться каменными углями со значительным содержанием летучих веществ. Рафинировочные печи не допускают отопления их высокосернистыми сортами топлива.
Природное топливо не всегда отвечает по своему качеству требованиям металлургии. Поэтому топливо подвергают специальным процессам обработки, улучшающим его качество, а также позволяющим выделить из топлива ряд ценных продуктов. К процессам обработки, которым подвергают сырое природное топливо, относятся: обогащение твердого топлива, газификация твердого топлива, коксование и полукоксование углей, приготовление угольной пыли, брикетирование мелочи, выжиг угля из древесины, переработка нефти с выделением легких фракций жидкого топлива, конверсия природного газа и др.
Углеродистое топливо представляет ценнейшее сырье, позволяющее вырабатывать из него большое количество разнообразных химических продуктов. Поэтому в последнее время выдвигаются новые, так называемые энерготехнологические схемы переработки топлива, включающие в себя полную его технологическую и энергетическую переработку. Примером такой схемы может служить переработка бурых углей, состоящая из полукоксования угля и технологической переработки жидких и газообразных продуктов полукоксования — смолы и газов. Получаемый при полукоксовании полукокс сжигается в печах или топках. Применение в печах высококачественного, соответствующим образом подготовленного топлива обеспечивает высокопроизводительную и экономичную работу металлургических печей и хорошее качество получаемых металлов, сплавов и полупродуктов. Выбор того или иного вида топлива для печи определяется требованиями технологического процесса, условиями оптимального теплового режима и экономическими показателями.
Теоретическая часть
Основные свойства топлива
1) Химический состав;
2) Отношение к нагреванию;
3) Теплотворность;
4) Калориметрическая температура горения.
Химический состав топлива представлен углеродом, водородом, азотом, кислородом, серой. Кроме этих элементов, топливо содержит воду  и минеральные включения, образующие золу А.
и минеральные включения, образующие золу А.
Важнейшая составная часть топлива — углерод, при горении которого выделяется основное количество тепла. Содержание углерода в топливе достигает 85—90%. Углерод находится в топливе в виде органических соединений, состав и соотношение которых не всегда точно установлены. Водород, находящийся в топливе в не связанном с кислородом виде, в зависимости от его содержания при горении также выделяет заметное количество тепла.
Азот, кислород и связанный с кислородом водород являются органическим балластом топлива, ухудшающим его состав и энергетическую характеристику. Сера в топливе находится в виде органических соединений  , сульфидов (колчеданная сера)
, сульфидов (колчеданная сера)  и сульфатов
и сульфатов  . Органическая и сульфидная сера при горении выделяют тепло, но, несмотря на это, значительное содержание серы в топливе нежелательно вследствие загрязнения атмосферы и изделий сернистыми продуктами.
. Органическая и сульфидная сера при горении выделяют тепло, но, несмотря на это, значительное содержание серы в топливе нежелательно вследствие загрязнения атмосферы и изделий сернистыми продуктами.
Влага, содержащийся в топливе, весьма нежелательная балластная составляющая, снижающая качество топлива. При повышенном содержании влаги топливо может быть обесценено. Топливо, потребляемое металлургическими печами, в ряде случаев сушат для снижения влажности. Различают внешнюю влагу, которая удаляется при сушке топлива без значительного подогрева ( 40 С), и внутреннюю, или гигроскопическую, удаляемую при нагреве до
40 С), и внутреннюю, или гигроскопическую, удаляемую при нагреве до  .
.
Зола — балласт топлива, снижающая его качество и ценность. Содержание золы может колебаться в различных видах топлива в широких пределах. Обычно под золой топлива понимают твердый негорючий остаток, полученный после сжигания навески топлива. Зола имеет минеральный состав, представленный различными окислами, сульфатами и т. п. (окислы железа, кремния, алюминия, магния, натрия, калия; сульфаты железа, кальция и т. д.). Большое значение имеет температура плавления золы, влияющая на повеление золы в металлургических печах. При высокой зольности топлива температура плавления золы может существенно влиять на тепловой и технологический режимы печей и вызывать серьезные затруднения в работе. Поэтому для металлургических печей следует выбирать малозольное топливо или принимать меры к снижению зольности обогащением.
Химический состав твердого и жидкого топлива определяют элементарным анализом, при котором находят содержание перечисленных выше основных элементов, влаги и золы в процентах, причем кислород обычно определяют по разности вычитанием из 100% всех остальных компонентов.
Результаты элементарною анализа топлива можно записать в виде следующего уравнения, которое представляет состав так называемого рабочего топлива.

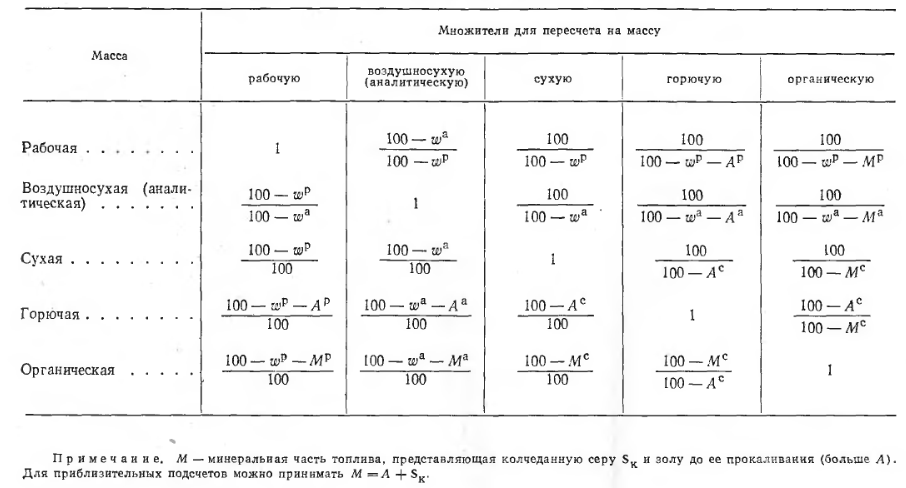
В ряде случаев химический состав топлива дают в пересчете на воздушносухое топливо, на абсолютно сухое топливо, на условную горючую массу или на условную органическую массу. Сущность этих наименований и методика пересчета на тот или иной состав наиболее наглядно поясняются приведенной в таблице 1 схемой состава топлива. Как следует из этой схемы, например за условную горючую массу топлива принимают сумму С, Н, О, N и S и элементарный анализ пересчитывают, принимая сумму этих пяти элементов за 100%. Аналогично этому в состав воздушносухого Топлива включают С, Н, О, N, S,А и содержание гигроскопической влаги  , представляющее разность между содержанием общей влаги
, представляющее разность между содержанием общей влаги  и внешней влагой
и внешней влагой  . Последняя определяется при подсушке топлива при температуре не выше 50 OС, в то время как общая влажность топлива определяется при подсушке топлива при температуре 103—105 OС.
. Последняя определяется при подсушке топлива при температуре не выше 50 OС, в то время как общая влажность топлива определяется при подсушке топлива при температуре 103—105 OС.
Таблица 1. Схема состава твердого и жидкого топлива

В зависимости от методики пересчета результатов элементарного анализа топлива к буквенным обозначениям составляющих добавляют соответствующие индексы. Например, для рабочего топлива все составляющие имеют индекс «р»: СP, НP, ОP, NP и т.д., для условной горючей массы — индекс «г»: СГ, НГ, ОГ, NГ и т.д.
Для пересчета данных по составу твердого и жидкого топлива из одной массы в другую применяют множители, приведенные в таблице 2. Если, например, известно содержание углерода в органической массе какого-либо топлива СГ, %, то соответствующее содержание углерода в рабочем топливе СР, %, будет

Химический состав газообразного топлива представляется следующими газами: окисью углерода СО, водородом Н2, метаном СН4, этаном С2Н6, пропаном С2Н8, бутаном С4Н10, пентаном С5Н12, этиленом С2H4, ацетиленом С2Н2, прочими углеводородами  и сероводородом H2S. Кроме этих газов, в топливе содержатся негорючие газы: азот, кислород, двуокись углерода, сернистый газ, пары воды. Содержание перечисленных составляющих в объемных процентах определяется в газообразном топливе специальным газовым анализом, причем содержание азота вычисляют по разности. Содержание влаги в газообразном топливе определяют отдельно и выражают вг/м3 газа, поэтому состав жидкого топлива обычно дается в виде сухого газа:
и сероводородом H2S. Кроме этих газов, в топливе содержатся негорючие газы: азот, кислород, двуокись углерода, сернистый газ, пары воды. Содержание перечисленных составляющих в объемных процентах определяется в газообразном топливе специальным газовым анализом, причем содержание азота вычисляют по разности. Содержание влаги в газообразном топливе определяют отдельно и выражают вг/м3 газа, поэтому состав жидкого топлива обычно дается в виде сухого газа:

Таблица 2. Множители для пересчет состава твердого и жидкого топлива
Для пересчета на рабочее топливо, в состав которого входит и объем влаги, следует содержание влаги  , пересчитать на объем при нормальных условиях, приходящейся на 100 м3, сухого газа по формуле:
, пересчитать на объем при нормальных условиях, приходящейся на 100 м3, сухого газа по формуле:

Пользуясь этим выражением можно написать уравнение для пересчета состава сухого газа на рабочее топливо (влажный газ):



Кроме перечисленных составляющих газообразного топлива, в нем могут содержаться примеси в виде смолы и пыли. Содержание этих примесей выражается аналогично влаге в г/м3 и выносится за 100% основного состава сухого газа.
Отношение топлива к нагреванию определяется по изменению состава топлива при его нагревании, характеристике получаемых продуктов и температуре, при которой наблюдаются изменения состава и свойств топлива. По отношению к нагреванию все разновидности топлива делятся на теплонестойкие и теплостойкие. Теплонестойкие виды топлива при нагревании разлагаются с образованием новых соединений: горючих газов, кокса и т. п. Почти все виды естественного (природного) топлива могут быть отнесены к теплонестойким, особенно твердое топливо. Теплостойкие виды топлива — это преимущественно искусственное топливо, прошедшее уже ту или иную обработку (древесный уголь, кокс, термантрацит, газы). Отношение топлива к нагреванию очень важно для рациональной организации процессов переработки топлива — газификации, коксования, перегонки, а также для процессов сжигания топлива.
Теплотворность, или теплота горения, топлива Q есть количество тепла, выделяющегося при полном сгорании единицы топлива по реакциям окисления:




Для твердого и жидкого топлива теплотворность выражается вккал/кг, для газообразного — вккал/м3. За основной показатель тепловой ценности топлива принята так называемая низшая теплотворность рабочего топлива  , которая определяется на единицу рабочего топлива при условии, что имеющаяся в топливе и образующаяся при горении влага находится в парообразном состоянии. При условии конденсации всего водяного пара с выделением скрытой теплоты парообразования получается высшая теплотворность топлива, обозначаемая для рабочего топлива
, которая определяется на единицу рабочего топлива при условии, что имеющаяся в топливе и образующаяся при горении влага находится в парообразном состоянии. При условии конденсации всего водяного пара с выделением скрытой теплоты парообразования получается высшая теплотворность топлива, обозначаемая для рабочего топлива  . Очевидно, что
. Очевидно, что  превосходит
превосходит  па величину скрытой теплоты испарения образовавшегося при горении водяного пара, что выражается для твердого и жидкого топлива формулой
па величину скрытой теплоты испарения образовавшегося при горении водяного пара, что выражается для твердого и жидкого топлива формулой

где  и
и  — содержание водорода и влаги в рабочем топливе, %. Для газообразного топлива применяют формулу
— содержание водорода и влаги в рабочем топливе, %. Для газообразного топлива применяют формулу

где  ,
,  ,
,  ,
,  ,
,  — содержание составляющих, % (объемн.), во влажном газе.
— содержание составляющих, % (объемн.), во влажном газе.
Иногда теплотворность твердого и жидкого топлива определяют не для рабочего топлива, а для горючей или сухой массы, что выражается соответствующим индексом:  ,
,  и т. п. В этом случае для пересчета высшей теплотворности топлива с одного состава топлива на другой можно применять множители, приведенные в таблице 2. Для перехода к низшей теплотворности применяют формулы:
и т. п. В этом случае для пересчета высшей теплотворности топлива с одного состава топлива на другой можно применять множители, приведенные в таблице 2. Для перехода к низшей теплотворности применяют формулы:
 ,
,

Теплотворность топлива определяют экспериментально в лаборатории или рассчитывают по данным химического анализа. Экспериментально теплотворность для твердого и тяжелого жидкого топлива определяют в калориметрической бомбе, а для легкого жидкого и газообразного топлива — в специальном калориметре непосредственным измерением количества тепла, выделяющегося при сжигании определенного весового или объемного количества топлива. Теплотворность, определенную при помощи бомбы  , исправляют с учетом теплоты образования серной и азотной кислот, которые при сжигании топлива в печах не образуются, эти кислоты образуются в бомбе, при высоком давлении и избытке кислорода.
, исправляют с учетом теплоты образования серной и азотной кислот, которые при сжигании топлива в печах не образуются, эти кислоты образуются в бомбе, при высоком давлении и избытке кислорода.
Величину  пересчитывают в
пересчитывают в 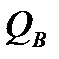 по уравнению
по уравнению

Расчет теплотворности топлива проводят по формулам, составленным на основании тепловых эффектов реакций окисления углерода, водорода, серы, окиси углерода, метана и других горючих составляющих и элементарного анализа топлива.
Из многочисленных формул, предложенных для расчета теплотворности топлива, наиболее приемлема формула Д. И. Менделеева для всех видов твердого и жидкого топлива, некоторые коэффициенты в которой исправлены нами по новым данным о тепловых эффектах:
 , ккал/кг
, ккал/кг
Теплотворность газообразного топлива рассчитывается по формуле:

Теплотворность различных видов топлива колеблется в различных пределах. Высокую теплотворность, достигающую до 10000 ккал/кг, имеет мазут, а так же и природный газ (8500 ккал/м3). Хороший каменный уголь и кокс имеют теплотворность около 7000 ккал/кг, дрова 3000 ккал/кг, генераторный газ 1300 ккал/м3.
Для сравнения тепловой ценности различных сортов топлива, для расчетов и отчетности пользуются понятием «условное топливо» при  = 7000 ккал/кг. Отношение теплотворности данного топлива к теплотворности условного называется калорийным эквивалентом. Для многих сортов топлива утверждены официальные калорийные эквиваленты, например для бензина 1,49, малосернистого мазута 1,425, кокса 0,93, кузнецкого каменного угля 1,0, кускового торфа 0,42, доменного газа 0,13 и т. д. Для газообразного топлива и дров калорийный эквивалент вычисляют делением объемной теплотворности
= 7000 ккал/кг. Отношение теплотворности данного топлива к теплотворности условного называется калорийным эквивалентом. Для многих сортов топлива утверждены официальные калорийные эквиваленты, например для бензина 1,49, малосернистого мазута 1,425, кокса 0,93, кузнецкого каменного угля 1,0, кускового торфа 0,42, доменного газа 0,13 и т. д. Для газообразного топлива и дров калорийный эквивалент вычисляют делением объемной теплотворности  , ккал/м3, также на 7000 ккал.
, ккал/м3, также на 7000 ккал.
Калориметрическая температура горения топлива tK, °С, есть та максимальная температура, до которой нагрелись бы продукты горения при условии, что сжигание велось бы с теоретическим количеством воздуха и все полученное тепло полностью пошло только на нагрев продуктов полного горения, т. е.

где  — объемы продуктов полного горения, м3/кг;
— объемы продуктов полного горения, м3/кг;
 — средние теплоемкости продуктов горения в интервале температур от 0 до tK° ккал/(м3 *°С).
— средние теплоемкости продуктов горения в интервале температур от 0 до tK° ккал/(м3 *°С).
Средние теплоемкости газов приведены в приложениях.
Выражение для tk получено на основании теплового баланса горения топлива в идеальных адиабатических условиях и в предположении, что физическое тепло топлива и воздуха равно нулю. При расчетах калориметрической температуры горения различных видов топлива рекомендуется находить значение tk подбором подходящего значения, при котором уравнение превращается в тождество. Такой прием приходится применять из-за довольно сложной степенной зависимости теплоемкостей гг от температурыtK, вследствие чего прямое решение уравнения привело бы к необходимости решения уравнения по меньшей мере третьей степени.
Практически калориметрическая температура горения топлива недостижима, так как часть тепловой энергии всегда расходуется на диссоциацию продуктов горения, что особенно заметно при высоких температурах.
Температура, рассчитанная с учетом расхода тепла на частичную диссоциацию СO2 и Н20, носит название теоретической температуры горения топлива tтеор, °С и может определяться по формуле:

где  - физическое тепло, вносимое топливом и воздухом, ккал/кг или ккал/м3:
- физическое тепло, вносимое топливом и воздухом, ккал/кг или ккал/м3:

 - тепло, идущее на диссоциацию CO2 и H2O по реакциям:
- тепло, идущее на диссоциацию CO2 и H2O по реакциям:
 ,
,


Рис. 1. График для определения степени диссоциации углекислоты и водяного пара
Величину  находят по уравнению:
находят по уравнению:
 ккал,
ккал,
a и b – степень диссоциации CO2 и H2O в долях от исходного количества газов до диссоциации (рис. 1);
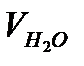 и
и  - объемы CO2 и H2O, образующиеся при горении единицы топлива при нормальных условиях, м3.
- объемы CO2 и H2O, образующиеся при горении единицы топлива при нормальных условиях, м3.
Теоретическая температура горения практически также недостижима, так как в реальных условиях сжигания топлива в рабочем пространстве печей и топок значительная доля тепловой энергии уходит из зоны горения и идет на нагревание окружающих тел. Температура, рассчитанная с учетом теплоотдачи зоны горения, называется практической температурой горения топлива tпр. Величину tпр можно находить по тепловому балансу топки или печи, но расчет этого баланса весьма сложен и требует детальных расчетов нестационарных теплообменных процессов, что зачастую затруднительно. Поэтому в расчетах печей и топок часто пользуются пирометрическим коэффициентом  , значение которого для различных типов печей и топок берут из данных заводских измерений. Величина
, значение которого для различных типов печей и топок берут из данных заводских измерений. Величина  колеблется от 0,6 до 0,9, и для металлургических печей с горизонтальным рабочим пространством и хорошо организованным процессом горения можно принимать
колеблется от 0,6 до 0,9, и для металлургических печей с горизонтальным рабочим пространством и хорошо организованным процессом горения можно принимать  . Задаваясь значением
. Задаваясь значением  и зная
и зная  , можно приблизительно определить максимальную практическую температуру горения топлива в данной печи по формуле:
, можно приблизительно определить максимальную практическую температуру горения топлива в данной печи по формуле:

Расчетная часть