Раздел 1. ОСНОВНЫЕ ФИЗИКО-ХИМИЧЕСКИЕ ВЕЛИЧИНЫ
МАКРО параметры
[ρ]~г/см3 = 1 у воды
[m]~г, кг, т–масса
молярная масса*
[ М ] ~г/моль
М(воздуха)= 29 г/моль
| n |
Qхим процесса
[V] ~дм3(л),м3,см3(мл) – объем
[ Vm ]~дм3/моль молярный объем*
= 22,4?! только при _____
и только для______
и только идеальных
NA – постоянная (или число???) Авогадро = 6,02·1023моль-1
:k ∙х
n(Х)
P ∙ V = n ∙ R ∙ T-
(п ора в ставать н а р або т у)
уравнение
Клапейрона-Менделеева
101,3 кПа = 1 атм = 760 мм.рт.ст
00С = 273 К R= 8,31 кДж/моль∙К
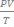 = соnst
= соnst
Nчастиц
“на порции делим” ~ моль – хим.количество*
НАНО параметры)
m атома, молекулы, иона =…·10-24г или …. кг
: mu=1,66·10-24г!!! mu=1/NA– u – юнит*
m атома=… а.е.м, где 1 а.е.м.= 1/12 m атома 12С r – радиус атома ~ Å(ангстрем)
мЭ (нуклид-*), где М-массовое число
Аr – атомная атома
Mr - относительная формульная масса показывают во сколько раз масса форм. единицы больше 1/12 массы 12С
молекулярная молекулы
Mr=∑ Аr·Nатомов (округление до целого значения ИСКЛ Ar(Сl)=35,5)
!Численно равны М атома и Аr; М вещества и Мr; (ДЗ доказать) Сравн. 1 кг и 1 л (числа равны, физ. смысл разный)
?2 Рассчитать Mr сахарозы С12Н22О11 =______ Mrf [Cu(NH3)4](OH)2=_________?3Mrf (Na2CO3∙10H2O) =______
|
Округление до 3-ей знач-й цифры
Или заданной точности после запятой 1, 0000)
? Выпишите безразмерные величины, используемые в химических расчетах_______________________________
?2 Какое число атомов содержится в 1 г алмаза? ____________________________________________________
?3Какая масса молекулы белого фосфора? __________________________________________________________
?4Какая масса озона может быть получена из 3,01·1021 молекул кислорода?
?5Какой объем воды (в см3) содержит столько же атомов водорода, сколько и 4,48 дм3 аммиака (н.у.):
 На основе схемы получения олеума FeS2 →SO2→SO3 →H2SO4→SO3∙3H2SO4, рассчитайте объем выделившегося сернистого газа (н.у., м3) и массу (кг) образовавшегося олеума, полученных из пирита, в котором содержится 2,4 тонн дисульфида железа (II).
На основе схемы получения олеума FeS2 →SO2→SO3 →H2SO4→SO3∙3H2SO4, рассчитайте объем выделившегося сернистого газа (н.у., м3) и массу (кг) образовавшегося олеума, полученных из пирита, в котором содержится 2,4 тонн дисульфида железа (II).
Расчеты по уравнениям химических реакций.
аА + бБ = гГ + дД
реагенты продукты
или  =
=  .
.
Обычные расчеты
если даны ФХВ для одного вещества (напр.А), реакция одна или ряд последовательных => строим логические схемы
α – степень превращения реагента, η – выход продукта.
ПЗ 1. Какая масса осадка выпадет при взаимодействии 9,8 г фосфорной кислоты с гидроксидом стронция?
ПЗ 2. Какой объем аммиака (при н.у.) можно получить из простых веществ, если объем исходного водорода равен 300 л, а практический выход - 43 %?
ПЗ 3. 200 г известняка с массовой долей основного компонента 54% и некарбонатными примесями обработали иодоводородной кислотой, полученное вещество осторожно выпарили. Потери в синтезе составили 5%. Какова масса полученной соли?
ПЗ 4. Молярная теплота сгорания водорода -142,2 КДж/моль. Какой объем кислорода необходим, чтобы при сжигании водорода получить 2844 кДж тепла, если потери тепла в этом процессе составят 20%.
ПЗ 5. Мольная доля кислорода в воздухе – 0,208. Какой объем воздуха необходим для сгорания 5,6 м3 природного газа с 1% негорючих примесей? Какая теплота при этом может быть получена, если при сгорании 1,6 г основного компонента природного газа выделяется 89,1 кДж.
ПЗ 6. Какова массовая доля серной кислоты, если в процессе ее полного взаимодействия её с оксидом алюминия массой 14,2 г было получено 524,2 г раствора?
ПЗ 7 Какую массу (т) магнетита с массовой долей основного компонента 87% необходимо взять для получения 1 тонны стали, содержащей 0,5% нежелезных примесей, если выход процесса составляет 75%.
Олимпиада 2015-16 г 10-4 и 11-4. Аммиачную селитру получают путем нейтрализации газообразным аммиаком 55%-ного раствора азотной кислоты. Эта реакция является экзотермической, что обеспечиваетисточник энергии для упаривания раствора и последующего нагрева продукта до состояния расплава. После гранулирования и специальной обработки противолеживающими добавками получают конечный продукт, содержащий 95% основного вещества.
Водород, необходимый для синтеза аммиака, получают путем конверсиии природного газа (96% метана по объему) водяным паром. На первом этапе продукт конверсии с выходом 95 % являются оксид углерода (II) и водород. На второй стадии выделенный из реакционной смеси оксид углерода (II) подвергают дальнейшей каталитической конверсии водяным паром, при этом с выходом 92% получается углекислый газ и водород. Азот, необходимый для синтеза аммиакак берут из воздуха (21% кислорода и 79% азота). При этом выход аммиака составляет 98%. На последующих стадиях из аммиака получают азотную кислоту, при этом её потери составляют 2,0%. а) Приведите уравнения всех реакций, протекающих в процессе получения аммиачной селитры. б) Рассчитайте, какую максимальную массу селитры можно получить из 100 м3(н.у.) природного газа.
РАСТВОРЫ: состав приготовление, смешение
1. Сколько воды надо добавить к 50 г 15%-ного раствора хлорида натрия, чтобы получить 10% раствор?
2. Какую массу кристаллической соды необходимо растворить в 200 г воды, чтобы при добавлении данного раствора в 50 г раствора с массовой долей карбоната натрия 10% получить 20% раствор?
3. Смешали 300 г 50%-ного раствора и 500 мл 20%-ного раствора (плотность 1,1 г/см3) гидроксида натрия. Какова массовая доля полученного раствора?
4. Какие объемы 20 %-ного (ρ=1,15) и 5 %-ного (ρ=1,05) растворов соли необходимо смешать для получения 300 г 8%-ного раствора?
5. В каком соотношении масс необходимо взять 10%-ный раствор сульфата меди и медного купороса, чтобы получить 30%-ный раствор?
6. Какой объем серной кислоты 94% с плотностью 1,74г/см3 необходимо добавить к 10 г раствора серной кислоты с мольной долей 0,01, чтобы получить 1 молярный раствор (ρ=1,061 г/см3)?
7. Определите концентрацию раствора фосфорной кислоты, полученного сливанием 200 мл 0,03 М р-ра и 300 мл 0,02 М р-ра. Какая массовая и мольная доля фосфорной кислоты в полученном растворе?
8. Какая масса осадка образуется при охлаждении 250 г 30%-ного раствора сульфата калия до 20 C0, если растворимость при данной температуре соли составляет 21,4 г на 100 г растворителя?
9. Приготовили 500 г насыщенного при 60 0С раствора сульфата меди. Какая масса медного купороса выкристаллизуется из раствора при охлаждении его до 0 0C? Растворимость сульфата меди при 60 0С равна 39,5 г, а при 0 0C – 14,3 г на 100 г воды.
10. запасная В результате охлаждения до 0 0С насыщенного при 100 0С раствора хлорида железа(II)- масса воды в котором 200 г в осадок выпало 89,0 г соли. Определите растворимость FeCl2 при 0 0С, если при 100 0С она равна 94,2 г на 100 г воды (49,7 г)