Теория строения органических соединений. Гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
I. Основные положения теории химического строения А.М. Бутлерова
| 1) Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения). Органические вещества содержат в своей основе УГЛЕРОДНЫЕ ЦЕПИ, в которых углерод имеет валентность IV. Связи между атомами углерода в органических цепях бывают одинарные, двойные и тройные. Кроме углерода, в органических веществах чаще всего присутствуют: атомы Н (одновалентные), атомы О (двухвалентные), а также атомы азота, галогенов и ещё некоторые виды атомов. Вещества, сходные по строению, но отличающиеся по составу на одну или несколько групп СН2, называются гомологами. 2) Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы. Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т.е. к появлению изомеров. Изомеры – это вещества, имеющие одинаковый состав, но разное строение молекул. 3) По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства. 4) Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества. |
II. Типы связей в молекулах органических веществ.
Строение атома углерода.
Электронное строение атома углерода изображается следующим образом: 1s22s22p2 или графически
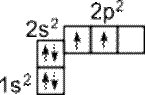
Такое состояние атома углерода называется основным или стационарным. За счет двух неспаренных электронов могут быть образованы 2 химические связи (валентность равна 2).
Углерод в органических соединениях четырехвалентен.
Это связано с тем, что при образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь. Схематически:
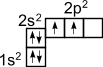 →
→ 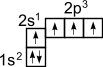
В результате имеется уже не два, а четыре неспаренных электрона, за счет которых могут быть образованы 4 связи (валентность равна 4).
δ (сигма) и π (пи)-связи
В молекулах органических веществ между атомами существуют, в основном, ковалентные малополярные связи (перекрываются электронные орбитали неспаренных электронов и возникает общая электронная пара). По способу перекрывания электронных орбиталей различают 2 вида связи:
δ-связь – это связь, в которой перекрывание орбиталей происходит ВДОЛЬ ОСИ, соединяющей ядра атомов.
δ-связь может быть образована всеми типами орбиталей (s,p,d, гибридными).
δ-связи – это основные связи в молекуле, они более прочные и образуют скелет молекулы.
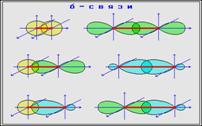
Между двумя атомами в химической частице возможна только одна σ-связь.
π-связь – это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной
оси, соединяющей ядра атомов, сверху и снизу от оси связи.
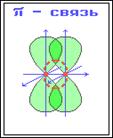 π-связь образуется при дополнительном перекрывании р- или d-орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-связь образуется при дополнительном перекрывании р- или d-орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-связь- дополнительная к δ-связи, она менее прочная и легче разрывается при химических реакциях.