Теоретическое введение
Электролитами называются вещества, химически разлагающиеся на составные части при прохождении через них электрического тока. К ним относятся растворы солей, являющихся в твердом состоянии ионными кристаллами. Носителями заряда в водных растворах электролита являются положительно и отрицательно заряженные ионы. В электрическом поле отрицательные ионы движутся к положительному электроду – аноду, положительные ионы – к отрицательному электроду – катоду. В водном растворе CuSO4 ионы Cu2+ осаждаются на катоде и нейтрализуются, присоединяя два электрона. Ионы SO42- движутся к аноду и, если он изготовлен из меди, взаимодействуют с ним, образуя сульфат меди CuSO4. Суммарный эффект состоит в том, что чистая медь переносится с анода на катод без уменьшения концентрации сульфата меди в растворе. В результате катод покрывается медью, а с анода медь постепенно переходит в раствор. Процесс выделения вещества на электродах при прохождении тока через электролит называется электролизом.
В 1874 г. ирландский физик Дж. Стоней ввел понятие элементарного электрического заряда и оценил его величину, используя метод электролиза. В основе этого метода лежат законы электролиза, открытые Фарадеем. Фарадей экспериментально установил, что масса вещества m, выделяющегося на электроде за время t при прохождении электрического тока через электролит, пропорциональна силе тока I и времени t:
 (11.1)
(11.1)
где k ‑ коэффициент, который зависит от природы вещества и называется электрохимическим эквивалентом вещества.
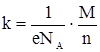 (11.2)
(11.2)
Здесь:
e – заряд электрона;
NA=6,023×1023 моль-1 – число Авогадро;
М – молярная масса вещества;
n – валентность вещества.
Подставляя значение k в (11.1), получим:
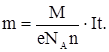 (11.3)
(11.3)
Из (11.3) найдем модуль заряда электрона
 (11.4)
(11.4)
Для меди М=0,064 кг/моль, n=2.
Приборы и принадлежности
Регулируемый источник постоянного напряжения (0-6 В); амперметр; медные электроды; сосуд с раствором медного купороса CuSO4; секундомер или часы; технические весы с разновесами.
Описание лабораторной установки
Схема лабораторной установки дана на рисунке 11.1. На схеме показаны: выходные клеммы (+,-) регулируемого источника питания (0-6 В), амперметр А, сосуд с водным раствором CuSO4, положительный медный электрод – анод Ан, отрицательный медный электрод – катод К.

Рис. 11.1
При помощи регулятора тока устанавливается определенная сила тока (0,5-1 А). Масса вещества m, выделившегося на электроде при электролизе, определяется по разности масс сухого катода после электролиза и до электролиза. Время электролиза t (10-20 мин) измеряется при помощи секундомера или часов.
Порядок выполнения работы
1. Снять и высушить катод. Определить его массу m1 путем взвешивания.
2. Установить катод и анод в растворе CuSO4.
3. Собрать электрическую схему (рис. 11.1).
4. Включить источник питания и секундомер. Быстро установить при помощи регулятора нужную силу тока в цепи. Поддерживать данную силу тока постоянной в течение всего эксперимента.
5. Через промежуток времени t, указанный преподавателем, отключить источник питания. Разобрать электрическую схему.
6. Снять и высушить катод. Определить его массу m2 после электролиза.
7. Найти массу m меди, выделившейся на катоде.
8. Используя соотношение (11.4) и результаты эксперимента, найти заряд электрона.
9. Определить абсолютную и относительную погрешности метода измерения заряда электрона e. Сравнить полученное значение с известным значением заряда электрона.
Контрольные вопросы
1. Что называется электролизом?
2. Объяснить процесс выделения меди на катоде при электролизе раствора сернокислой меди.
3. Сформулировать закон Фарадея для электролиза.
4. Устройство экспериментальной установки и методика эксперимента.