ОПРЕДЕЛЕНИЕ ПАРЦИАЛЬНЫХ МОЛЯРНЫХ ОБЪЕМОВ
КОМПОНЕНТОВ РАСТВОРА
Составитель: к.х.н., профессор Котенко Г.А.
г. Череповец – 2006 г.
Цель работы:
Формирование навыков использования графических методов к определению парциальных молярных объемов компонентов раствора.
Теоретическая часть
Раствор – это однородная многокомпонентная система переменного состава, состоящая из двух и более компонентов. При изучении многокомпонентных систем иногда возникает необходимость знать, какую долю вносит каждый компонент в общее свойство раствора. Парциальной молярной величиной называется доля свойства, вносимая каждым компонентом в общее свойство раствора. Парциальными молярными величинами могут обладать только экстенсивные свойства растворов.
Все свойства системы, с точки зрения термодинамики, подразделяются на интенсивные и экстенсивные. Интенсивными называются свойства системы, которые не зависят от массы и с течением времени в системе выравниваются. К ним относятся температура, давление, концентрация.
Экстенсивным называются свойства, которые суммируются в системе и пропорциональны массе. К ним относятся масса, объем, энтропия и т.д.
Льюис ввел математическое определение для парциальных молярных величин. Парциальной молярной величиной экстенсивного свойства данного компонента в растворе является частная производная общего свойства раствора по числу моль компонента при постоянном давлении и температуре и числах моль остальных компонентов.
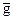 i = (
i = (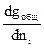 )p,T,nј, (1)
)p,T,nј, (1)
где 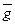 i – парциальная молярная величина свойства i-того компонента, gобщ – общая величина экстенсивного свойства, ni – число молей i-того компонента, р – давление, Т – температура, nј - число молей всех компонентов без i-того.
i – парциальная молярная величина свойства i-того компонента, gобщ – общая величина экстенсивного свойства, ni – число молей i-того компонента, р – давление, Т – температура, nј - число молей всех компонентов без i-того.
Среди парциальных молярных величин особое место занимает парциальная молярная свободная энергия:
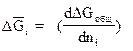 p,T,nј (2)
p,T,nј (2)
Парциальная молярная свободная энергия получила название химического потенциала и обозначается μ i.
μi = 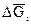 (3)
(3)
Химический потенциал является интенсивной величиной. Равенство химических потенциалов составных частей характеризует условие химического равновесия в системе.
Парциальные молярные величины характеризуют свойства компонентов сложных систем. Роль парциальных молярных величин в термодинамических расчетах соответствует роли основных экстенсивных свойств. Кроме того, парциальные молярные величины связаны с параметрами состояния также, как и основные свойства.
Взаимосвязь между основными экстенсивными свойствами системы в целом и их парциальными молярными величинами осуществляется и подчиняется закономерностям Гиббса-Дюгема:
1. Общее экстенсивное свойство системы равно сумме парциальных молярных свойств компонентов:
gобщ = 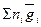 , или gобщ = n1
, или gобщ = n1 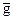 1 + n2
1 + n2 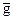 2; (4)
2; (4)
2. Суммарное изменение парциальных молярных свойств компонентов системы равно
нулю: 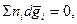 или
или 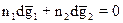 (5)
(5)
Существуют два метода определения парциальных молярных величин: аналитический и графический.
Аналитический метод заключается в том, что на первой стадии необходимо найти зависимость изучаемого экстенсивного свойства от состава, т.е. вывести формулу зависимости свойств от состава системы. Затем берется частная производная от этой зависимости по числу моль изучаемого компонента.
Графический метод применим только для двухкомпонентных систем. Сначала определяют общее экстенсивное свойство системы при различных составах компонентов, затем строят график зависимости свойства от состава и через исследуемую точку проводят касательную. Тангенс угла наклона касательной к положительному направлению оси абсцисс дает значение парциальной молярной величины изучаемого свойства того компонента, состав которого отложен на оси абсцисс.
Экспериментальная часть
Приборы и реактивы: аналитические весы, пикнометры на 25 мл, растворы солей К2SO4, NaCl, MgSO4 с моляльными концентрациями 0,025; 0,05; 0,10; 0,15; 0,20; 0,25 моль/кг.
Порядок выполнения работы
Взвесить на аналитических весах чистый сухой пикнометр. Наполнить пикнометр дистиллированной водой и вновь взвесить. Затем наполнять пикнометр последовательно водными растворами какой-либо соли различных концентраций в растворах по указанию преподавателя и каждый раз взвешивать. Полученные экспериментальные данные занести в таблицу 1.
Таблица 1
| Масса пикнометра,г (m0) | Масса пикнометра с водой,г (mв) | Масса пикнометра с раствором соли, г (mi) | |||||
| 0,025М | 0,05М | 0,10М | 0,15М | 0,20М | 0,25М | ||
Температура опыта –