Для студентов очной формы обучения
По профилю «Технология производства электрической и тепловой энергии»
Направления подготовки
Теплоэнергетика и теплотехника»
Казань 2016
УДК 621.311.22
ББК 31.37
Ч
Рецензент:
кандидат технических наук, доцент КГЭУ А.Ш. Низамова
Чичирова Н.Д., Саитов С.Р., Шагиев Н.Г., Абасев Ю.В.
Методические указания к выполнению расчётного задания по дисциплине «Принципы эффективного управления технологическими процессами в теплоэнергетике, теплотехнике и теплотехнологии» для магистрантов, обучающихся по профилю «Технология производства электрической и тепловой энергии». – Казань: Казан. гос. энерг. ун-т, 2016. – 28 с.
Методические указания содержат методику расчёта, варианты заданий и другие материалы для выполнения расчётного задания по дисциплине «Принципы эффективного управления технологическими процессами в теплоэнергетике, теплотехнике и теплотехнологии».
Издание предназначено для магистрантов направления 13.04.01 Теплоэнергетика и теплотехника, обучающихся по профилю «Технология производства электрической и тепловой энергии».
Настоящее издание может быть также использовано для выполнения контрольных работ студентами заочной формы обучения.
УДК 621.311.22
ББК 31.37
© Чичирова Н.Д., Саитов С.Р., Шагиев Н.Г., Абасев Ю.В., 2016
© Казанский государственный энергетический университет, 2016
Введение. Задание на выполнение расчёта
Целью расчёта является определение величины pH водного раствора бинарных отмывочных композиций для удаления отложений с теплообменных поверхностей оборудования тепловых и атомных электрических станций (ТЭС и АЭС). В таблице 1 приведены возможные варианты бинарных (двухкомпонентных) отмывочных растворов.
Таблица 1
Составы бинарных отмывочных композиций для удаления отложений
| Номер варианта | Компонент 1 | Компонент 2 |
| ДТПК | ЛК | |
| НТК | ЩК | |
| ЭДТК | ОЭДФ | |
| ОЭДФ | УК | |
| НТФ | ФК | |
| ДТПК | ФК | |
| НТК | ЛК | |
| ЭДТК | ЩК | |
| НТК | ОЭДФ | |
| НТФ | УК | |
| ДТПК | УК | |
| НТК | ФК | |
| ЭДТК | ЛК | |
| ОЭДФ | ЩК | |
| ЭДТК | НТФ | |
| ДТПК | НТФ | |
| НТК | УК | |
| ЭДТК | ФК | |
| ОЭДФ | ЛК | |
| НТФ | ЩК | |
| ДТПК | ОЭДФ | |
| НТК | НТФ | |
| ЭДТК | УК | |
| ОЭДФ | ФК | |
| НТФ | ЛК |
Названия кислот в этой таблице: ОЭДФ – оксиэтилидендифосфоновая, ДТПК – диэтилентриаминпентауксусная, ЛК – лимонная, ЩК – щавелевая, ЭДТК – этилендиаминтетрауксусная, НТФ – нитрилотриметилфосфоновая, ФК – фталевая, НТК – нитрилотриуксусная, УК – уксусная.
Каждый студент получает индивидуальное задание на расчёт, в котором указываются оба компонента бинарного раствора и их концентрации, для которых необходимо определить величину pH. Объём задания может варьироваться в целях индивидуализации обучения магистрантов. При этом разработка соответствующей математической модели процессов является обязательной для всех обучающихся.
В результате выполнения расчётного задания у студентов формируется компетенция: готовность применять методы и средства автоматизированных систем управления технологическими процессами в теплоэнергетике, теплотехнике и теплотехнологиях.
Математическая модель равновесных процессов в системе
«ДТПК – щавелевая кислота – вода»
Исходные данные
ДТПК является пятиосновной кислотой и может быть представлена в виде H5L, где L5- – лиганд этой кислоты, имеющий заряд «5-». Молекулярная масса данного вещества MDTPK =393,35 г/моль (здесь и далее обозначения всех величин, которые используются в математической модели, соответствуют своим обозначениям в компьютерной программе расчёта и сделаны латинскими буквами, поскольку этого требует выбранный язык программирования «Python»). Щавелевая кислота – двухосновная, H2M, где M2- – её лиганд. Молекулярная масса этой кислоты MSK =90,04 г/моль.
Отрицательные десятичные логарифмы констант равновесия реакций ступенчатой диссоциации ДТПК в водном растворе с первой по пятую ступень, заимствованные из таблицы 2, составляют при ионной силе раствора µ=0,1 соответственно: pK1Д=10,45; pK2Д=8,53; pK3Д=4,28; pK4Д=2,65; pK5Д=1,82. Аналогичные данные для щавелевой кислоты, приведенные в таблице 2 при нулевой ионной силе раствора: pK1Щ=4,266; pK2Щ=1,252.
Ионные равновесия в системах «ДТПК – вода»
и «щавелевая кислота – вода»
Уравнения равновесия реакций ступенчатой диссоциации ДТПК в водном растворе с первой по пятую ступень соответственно:
(На этой странице будет таблица 2 с константами равновесия для всех кислот. Эта таблица находится в отдельном файле, названном «с.5 – таблица Константы диссоциации некоторых кислот»)
 ;
;
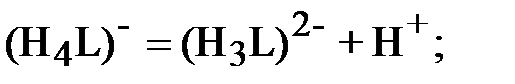
| (1) |
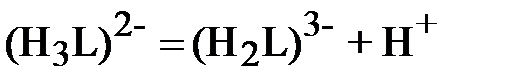 ;
;
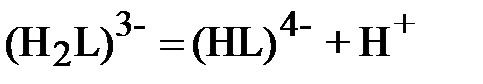 ;
;
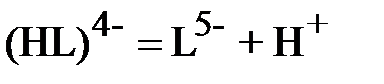 .
.
Аналогичные уравнения для щавелевой кислоты:
| (2) |
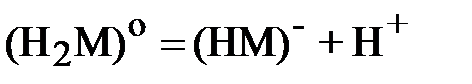 ;
;
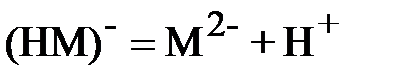 .
.
Константы равновесия реакций диссоциации ДТПК:
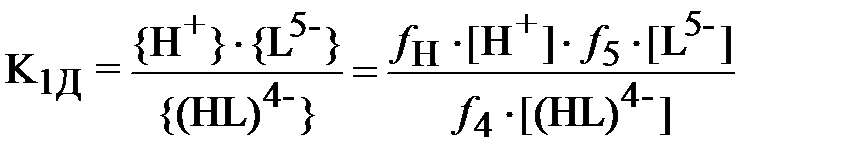 ;
;
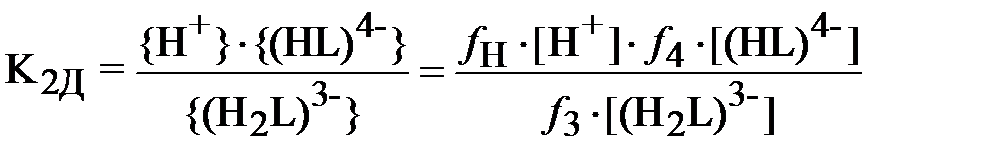 ;
;
| (3) |
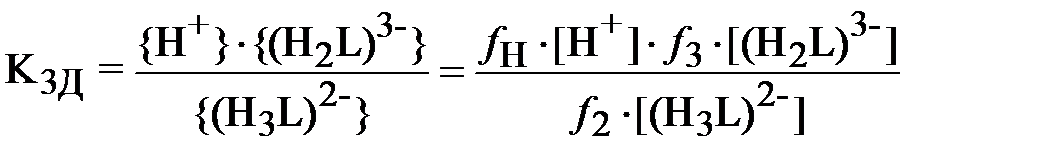 ;
;
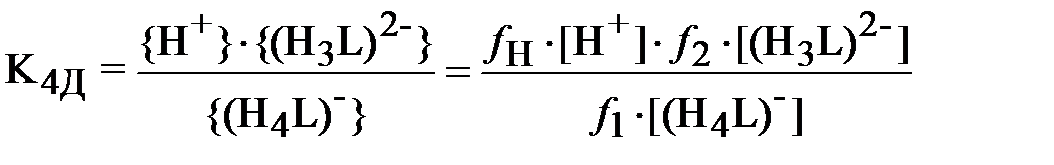 ;
;
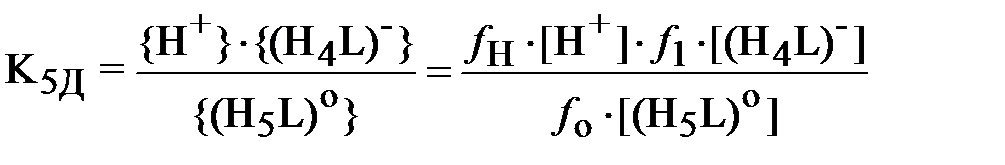 .
.
Для щавелевой кислоты:
| (4) |
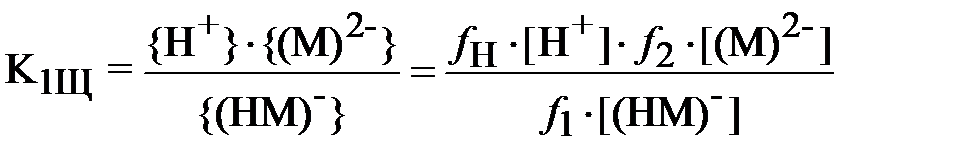 ;
;
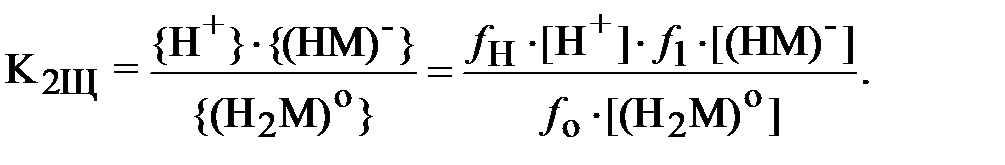
В формулах (3) и (4) выражения в фигурных скобках означают активности (моль/л), а в квадратных скобках – концентрации (моль/л) соответствующих ионов, fi – коэффициент активности i -го иона.
Общая формула для нахождения коэффициента активности i -го иона:
| (5) |
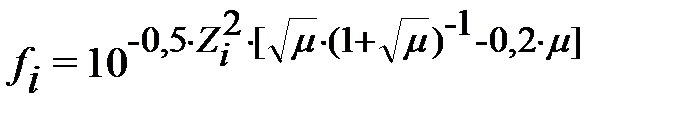 .
.
Отсюда видно, что f o=1, так как заряд в этом случае равен 0.
Введём вспомогательную величину A, необходимую для определения коэффициентов активности ионов в водном растворе:
| (6) |
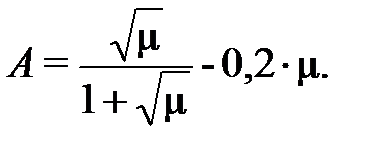
Подчеркнём, что для ЩК константы равновесия приведены в таблице 2 при нулевой ионной силе раствора, а для ДТПК – при µ=0,1. Константы, полученные при ионной силе раствора, отличной от 0, необходимо привести к нулевой ионной силе. Для пересчёта на нулевую ионную силу констант равновесия реакций диссоциации ДТПК (известных нам при µ=0,1) вспомогательная величина A составит:
| (7) |
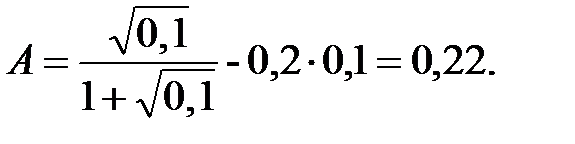
Коэффициенты активности различных ионов, с учётом уравнений (5) и (6), составят:
 – коэффициент активности однозарядного иона H+;
– коэффициент активности однозарядного иона H+;
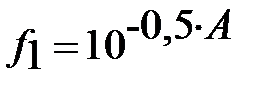 – коэффициенты активности однозарядных ионов (H4L)- и (HM)-0;
– коэффициенты активности однозарядных ионов (H4L)- и (HM)-0;
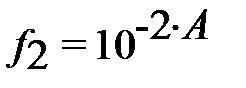 – коэффициенты активности двухзарядных ионов (H3L)2- и (M)2-;
– коэффициенты активности двухзарядных ионов (H3L)2- и (M)2-;
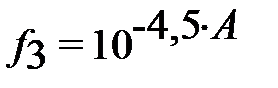 – коэффициент активности трёхзарядного иона (H2L)3-;
– коэффициент активности трёхзарядного иона (H2L)3-;
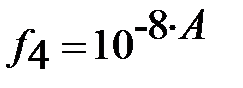 – коэффициент активности четырёхзарядного иона (HL)4-;
– коэффициент активности четырёхзарядного иона (HL)4-;
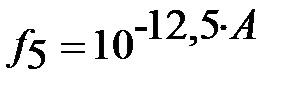 – коэффициент активности пятизарядного иона L5-.
– коэффициент активности пятизарядного иона L5-.
Тогда пересчитанный на нулевую ионную силу отрицательный десятичный логарифм константы равновесия реакции диссоциации ДТПК в водном растворе по первой ступени будет равен:
| (8) |
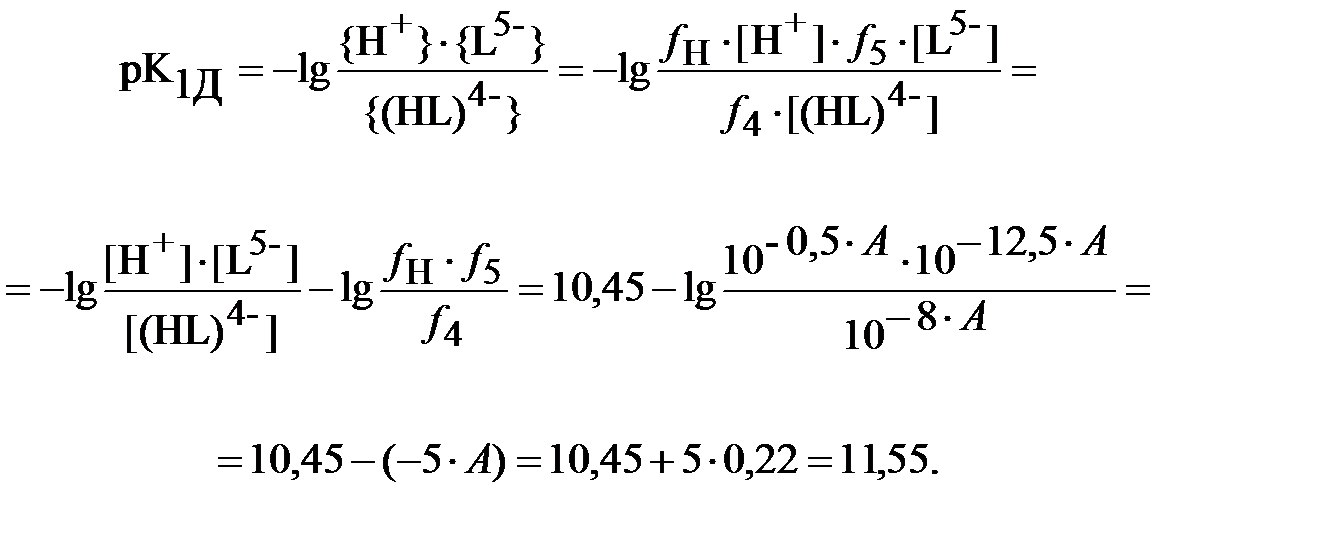
Аналогичным образом должны быть приведены к нулевой ионной силе раствора остальные константы для ДТПК – по второй, третьей, четвёртой и пятой ступеням диссоциации.
Запишем уравнения (3) и (4) для констант равновесия реакций диссоциации обеих кислот с учётом полученных значений коэффициентов активности различных ионов (здесь и далее для ДТПК используются константы диссоциации, уже пересчитанные на нулевую ионную силу вышеприведенным способом):
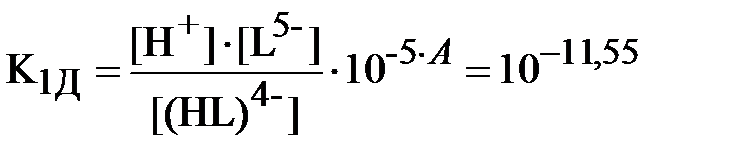 ;
;
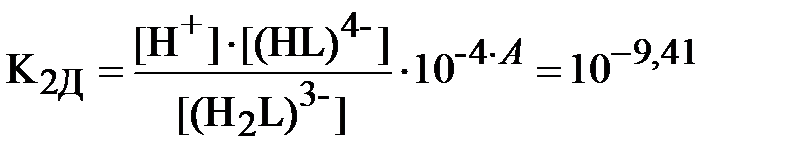 ;
;
 ;
;
| (9) |
 ;
;
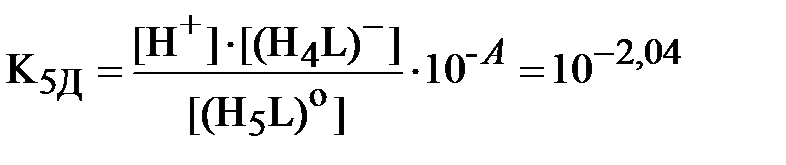 ;
;
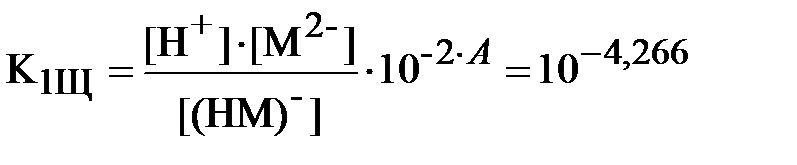 ;
;
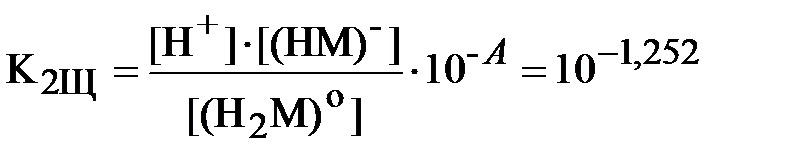 .
.
Определим суммарную концентрацию всех ионных форм ДТПК в водном растворе, равную исходной концентрации этого реагента [ L о], моль/л, при приготовлении отмывочной композиции:
| (10) |
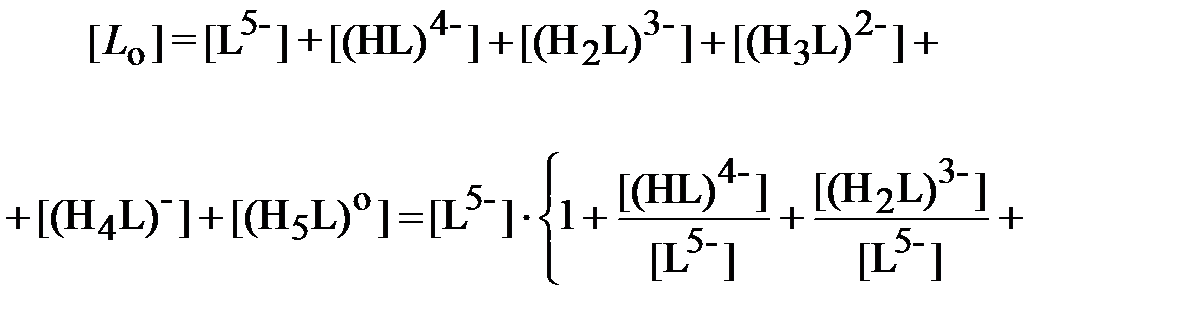
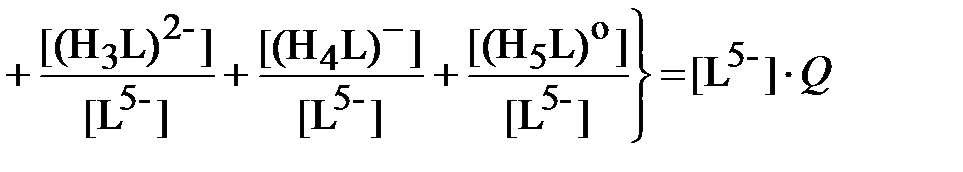 .
.
Отметим, что из определения величины pH следует:
| (11) |
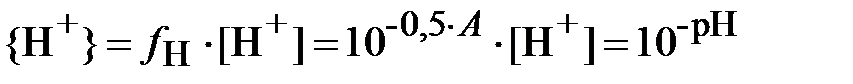 .
.
Если все дробные выражения в формуле (10) найти из соответствующих уравнений для констант равновесия (9), то функция Q запишется следующим образом:
| (12) |
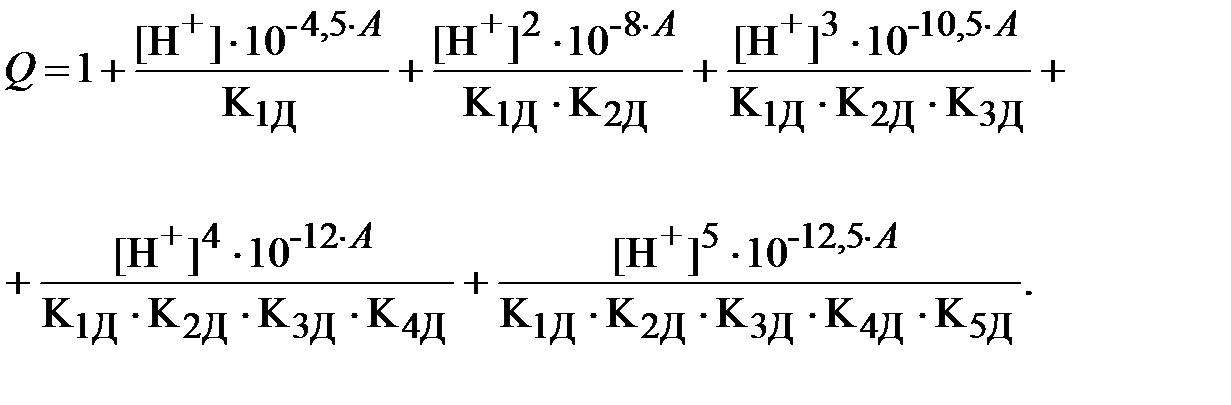
В выражении для Q третье слагаемое получено с помощью перемножения констант равновесия реакций диссоциации ДТПК по первой и второй ступеням, четвёртое слагаемое - перемножением констант по 1-3 ступеням и т.д.
Обозначим:
| (13) |
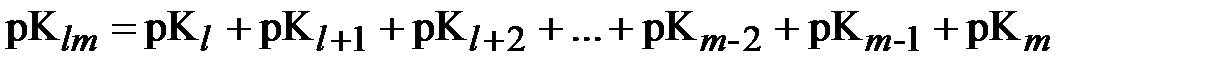 ,
,
где произвольное слагаемое 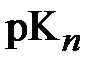 в правой части этого выражения представляет собой отрицательный десятичный логарифм соответствующей константы равновесия;
в правой части этого выражения представляет собой отрицательный десятичный логарифм соответствующей константы равновесия; 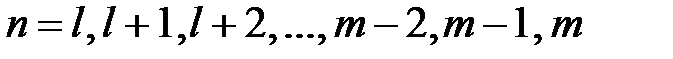 .
.
Подставив численные значения констант равновесия, пересчитанные на нулевую ионную силу, и выразив концентрацию ионов водорода через величину pH с помощью формулы (11), получим:
| (14) |
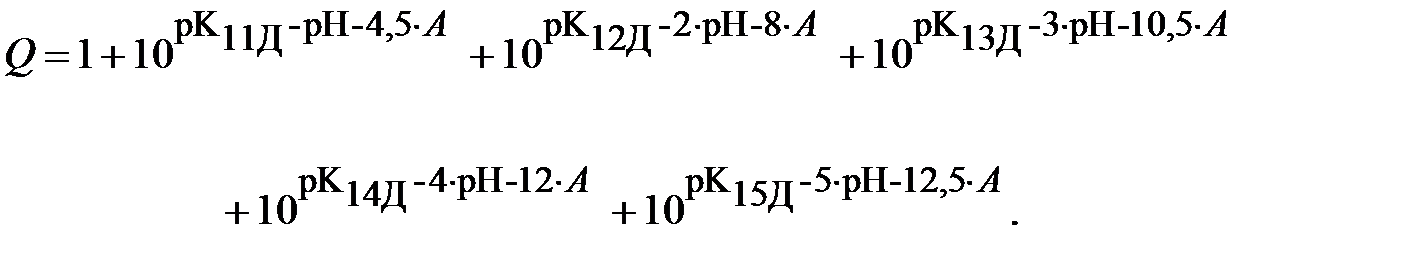
Здесь pK11Д  pK1Д, а, например, pK14Д
pK1Д, а, например, pK14Д 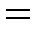 pK1Д + pK2Д + pK3Д + pK4Д.
pK1Д + pK2Д + pK3Д + pK4Д.
Аналогичным образом находится суммарная концентрация всех ионных форм ЩК в водном растворе, равная исходной концентрации этого реагента [ M о], моль/л, при приготовлении отмывочной композиции:
| (15) |
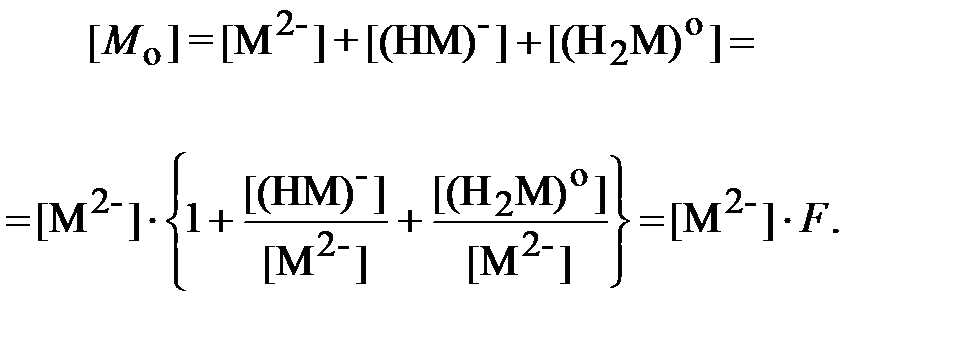
Функция F для ЩК, аналогичная функции Q для ДТПК, равна:
| (16) |
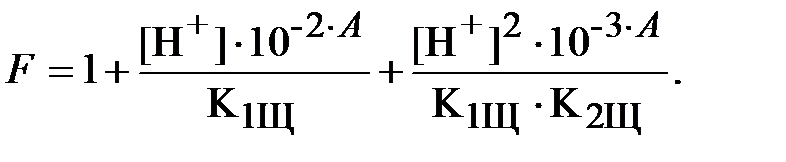
Выразим функцию F через константы равновесия и величины pH и A:
| (17) |
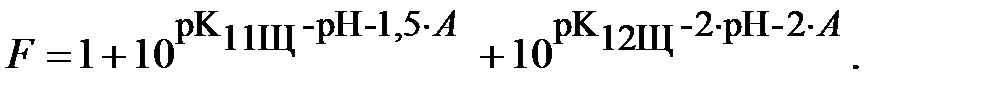
Для определения ионной силы раствора нужно найти относительные концентрации (доли) всех ионных форм ДТПК 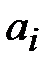 и ЩК vi:
и ЩК vi:
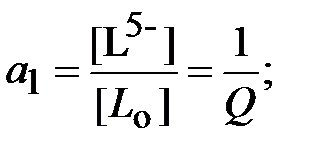
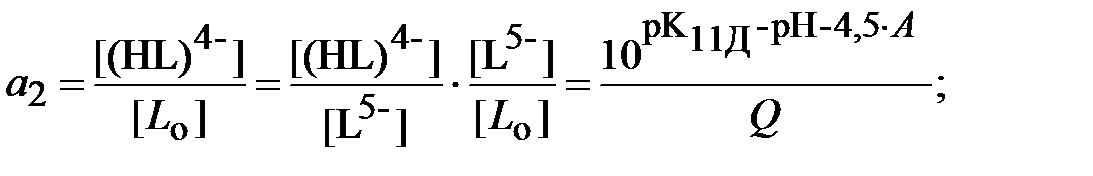
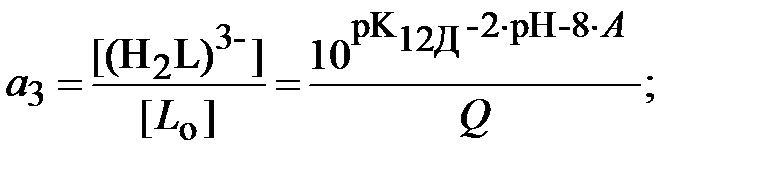
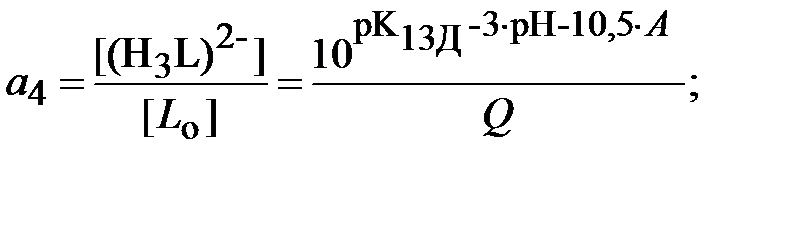
| (18) |
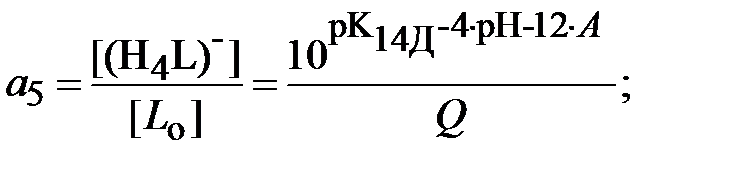
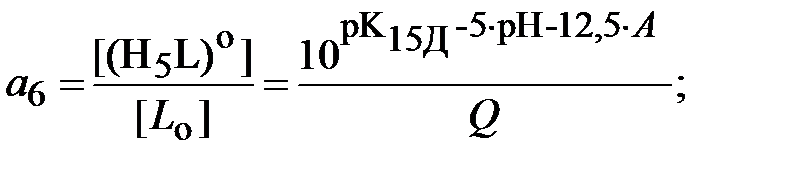
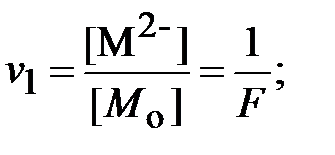
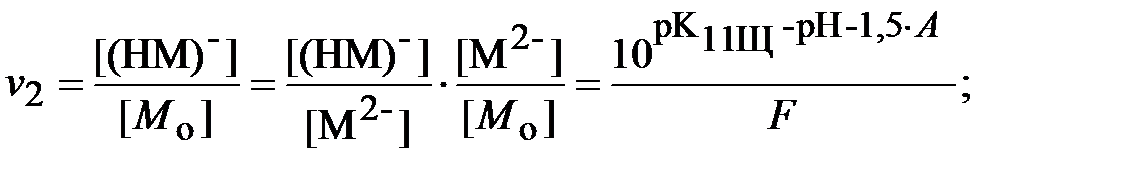
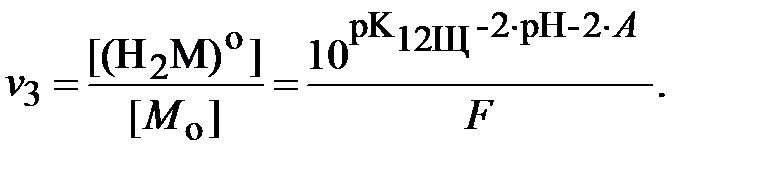
Дозировка моющих веществ в отмывочный контур производится, как правило, из специального бака-дозатора. В нём готовится исходный раствор со значительно более высокой концентрацией реагента по сравнению с той, которая требуется для процесса химической очистки. В случае недостаточно высокой растворимости в воде комплексонов применяют их натриевые соли, для которых этот показатель может быть существенно выше. В таком случае молярная концентрация ионов натрия в водном растворе составит C ·[ L о], где C – степень замещения по натрию. Величина C показывает, сколько ионов водорода в молекуле комплексона замещается на ионы натрия (в среднем по всему раствору). С учётом этого ионная сила раствора равна:
| (19) |
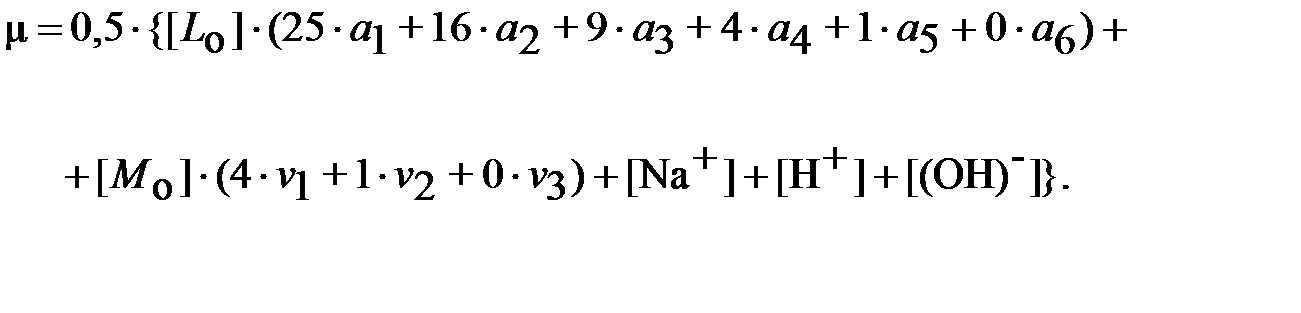
Для нахождения величин [H+] и [OH-] запишем выражение для ионного произведения воды, с учётом (11):
| (20) |
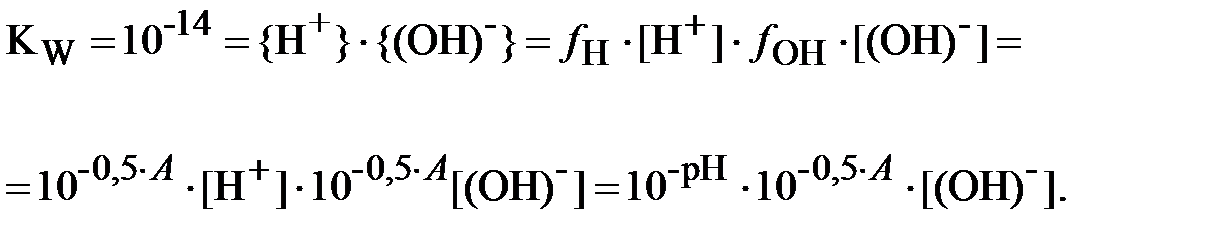
С помощью формул (11) и (20) находим:
| (21) |
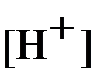
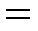
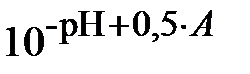 ;
;
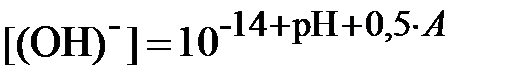 .
.
Из вышесказанного следует, что в формуле (19) 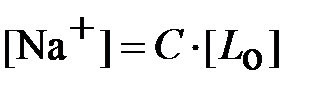 .
.
Найдём условный суммарный отрицательный заряд всех ионных форм ДТПК в водном растворе:
| (22) |
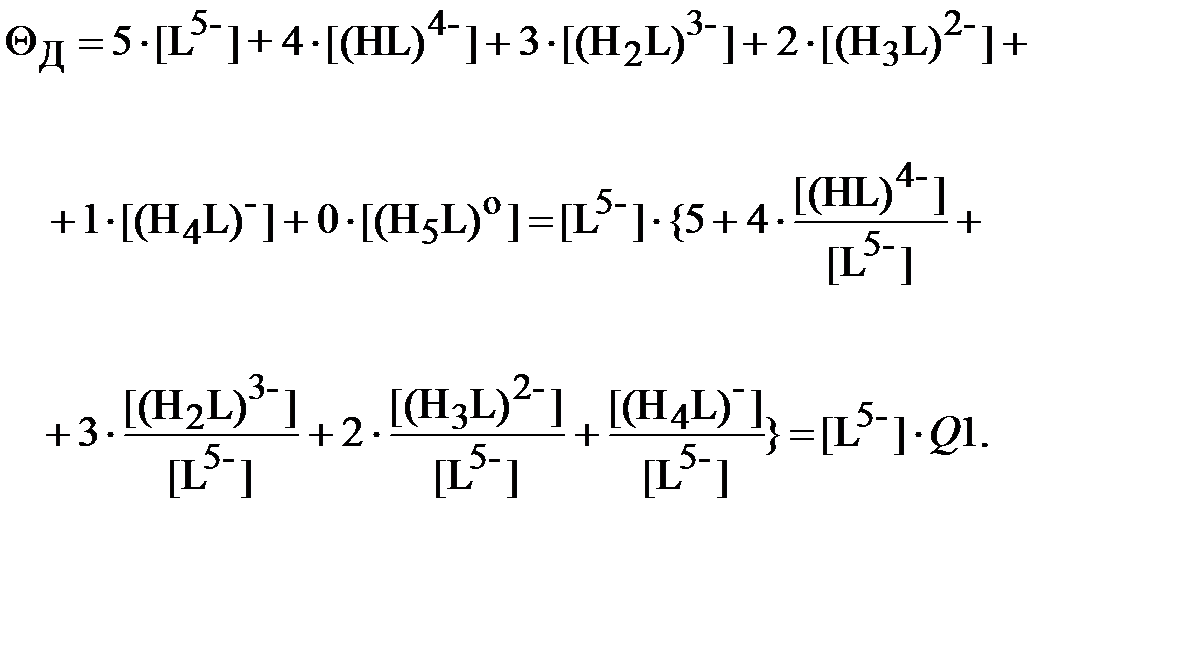
Сравнивая выражения для функций Q и Q1, можно записать:
| (23) |

Аналогичным образом для щавелевой кислоты:
| (24) |
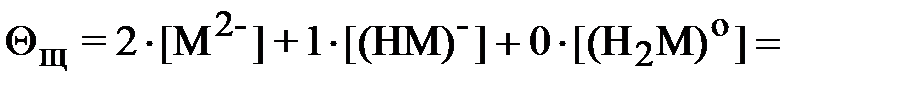
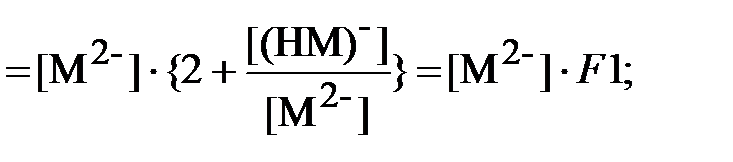
| (25) |
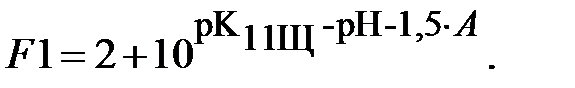
Теперь можно записать уравнение электронейтральности водного раствора, содержащего ДТПК или её натриевую соль со степенью замещения C и щавелевую кислоту:
| (26) |
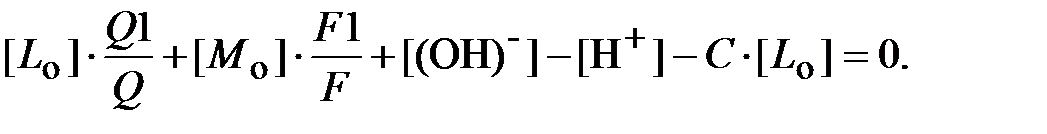
Это уравнение отражает равенство суммарных положительных и отрицательных зарядов всех ионов, присутствующих в водном растворе.