Холестерин.

Основа – циклопентанпергидрофенантрен Биосинтез ХС в клетках печени, тонкого кишечника и кожи осуществляется из АцКоА, который освобождается в результате распада белков, липидов и углеводов. Эндогенный ХС синтезируется преимущественно в печени (85%), в небольшой степени в тонком кишечнике (10%) и коже (5%). Всего в организме взрослого здорового человека массой 70 кг за сутки образуется 2,8-3,5 г ХС. С пищей за сутки в организм поступает около 0,3 г ХС. Источником ХС для организма человека являются липиды пищи и эндогенный холестерин. Печень участвует в распределении ХС между клетками органов и тканей через транспортные ЛП крови. На экспорт ХС синтезируется только печенью и тонкой кишкой. Холестерин является обязательным компонентом клеток. Наиболее богата ХС плазматическая мембрана гепатоцитов, где на его долю приходится 30% всех мембранных липидов. В миелине уровень ХС составляет 20%. В свободном виде и в виде эфиров он содержится в ЛП крови, входит в состав жировых включений цитоплазмы. В организме человека ХС выполняет следующие функции:1. структурная – ХС является структурным компонентом биомембран клеток. Принимает участие в регуляции их проницаемости, регулирует активность ферментов, работу рецепторов и переносчиков биомембран;2. метаболическая – связана с тем, что ХС является предшественником стероидных гормонов (андрогены, эстрогены, минерало- и глюкокортикоиды), витамина D3 и желчных кислот. Процесс биосинтеза ХС сложный и многоступенчатый и включает 35 реакций. Детали синтеза ХС практического врача не интересуют, поскольку многочисленные попытки управлять этим процессом в терапевтических целях оказались безуспешными, но знать схему биосинтеза надо. Источником БС ХС является ацетил-КоА, который образуется в результате катаболизма белков, углеводов и липидов. В синтезе холестерина можно выделить три основные стадии: I – превращение активного ацетата в мевалоновую кислоту,II –образование сквалена из мевалоновой кислоты, III – циклизация сквалена в холестерин. Начальным этапом синтеза мевалоновой кислоты из ацетил-КоАявляется образование ацетоацетил-КоА посредством обратимой тиолазной реакции:
|
|
Затем при последующей конденсации ацетоацетил-КоА с 3-й молекулой ацетил-КоА при участии гидроксиметилглутарил-КоА-синтазы (ГМГ-КоА-синтаза) образуется β-гидрокси-β-метилглутарил-КоА:
Далее β-гидрокси-β-метилглутарил-КоА под действием регуляторного фермента НАДФ зависимой гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-KoA превращается в мевалоновую кислоту:
Освободившийся в результате распада клеток, ХС с помощью ЛПВП транспортируется в печень, где при участии цитохрома Р450 окисляется с образованием желчных кислот. примерно 80% окисленного ХС выводится с желчными кислотами через кишечник в виде капостеринов
16.Жирные кислоты. Жирные кислоты - это алифатические карбоновые кислоты число атомов в которых может достигать 22 24 Основная масса жирных кислот входящих в организм человека и животных имеет четное число атомов углерода что связано с особенностями их синтеза Дело в том, что синтез идет путем тотарного удлинения углеродной цепочки Жирные кислоты как правило имеют неразветвленную углеводородную цепь Они подрюоеляются на насыщенные жирные кислоты - не имеющие в своей структуре двойных связей И ненасыщенные жирные кислоты имеющие в своей структуре двойные или даже тройные С - С связи (тройные встречаются крайне редко) Ненасыщенные жирные кислоты в свою очередь деются на а) моноеновыете содержащие одну двойную связь б) полиеновые, содержащие много двойных связей (диеновые, триеновые и др) Все природные ненасыщенные жирные кислоты имеют стереохимическую цис- конфигурацию так называемая цнс-ол-изомерия. Природные ненасыщенные жирные кислоты обычно имеют тривиальное название, например алеиновая, линоливая, линоленовая арахидоновая
|
|
17.Желчные кислоты. Строение. Биологическая роль. Парные желчные кислоты. Основную роль в переваривании пищи играют желчные кислоты, которые образуются в печени из холестерина. В основе всех желчных кислот лежит структура циклопентанпергидрофенантрена:  Родоначальником желчных кислот является холевая кислота, которая содержит ОН-группу в 3, 7 и 12 положениях. Производными холевой кислоты являются: 1. хенодезоксихолевая кислота, которая имеет 2 ОН-группы в 3 и 7 положениях; 2. дезоксихолевая кислота, имеющая окси-группы в 3 и 12 положениях; 3. литохолевая кислота, имеющая одну окси-группу в 3 положении. Большая часть желчных кислот в печени конъюгирована глицином и таурином. Их еще называют парные желчные кислоты, например гликохолиевые, таурохолиевые кислоты. Соотношение конъюгатов меняется в зависимости от характера принимаемой пищи. В случае преобладания углеводов увеличивается содержание глициновых конъюгатов. Если преобладают белки в диете, то увеличивается содержание тауриновых конъюгатов. Выделение желчных кислот способствует: 1. эмульгированию жира; 2. активации панкреатических липаз, фосфолипаз; 3. способствуют всасыванию труднорастворимых в воде веществ: ВЖК, ХС, моношлицеридов, жирорастворимых витаминов. При эмульгировании жир дробится на мелкие капельки, что значительно увеличивает поверхность контакта липида с ферментами. Желчные кислоты обволакивают эти капельки, препятствуя тем самым их слиянию. Таким образом стабилизируется эмульсия жира, который будет подвергаться гидролизу под влиянием панкреатических липаз. Помогают гидролизу жира ионы Са2+, которые образуют комплекс со свободными ВЖК. [рис. гидролиза трипальмитина: трипальмитин +3 воды® (липаза) глицерин+ 3 С15Н31СООН] [рис. гидролиза фосфатидилхолина: фосфатидилхолин +4 воды®(фосфолипазы А1, А2, С, D) глицерин + С15Н31СООН + С17Н31СООН +Н3РО4 +НО-СН2- СН2-Nº(СН3) 3] Фосфолипаза А1 действует на связь между глицерином и предельной ВЖК, А2 – между глицерином и непредельной ВЖК, С – между глицерином и фосфорной кислотой, D – между фосфорной кислотой и холином (HO-CH2-CH2-N+(CH3)3). В результате гидролиза пищевого жира образуются спирты, фосфаты, ВЖК, азотистые основания, АК и другие соединения. Необходимо отметить, что в расщеплении жиров принимают участие и кишечные липазы, но их активность невысокая. К тому же они расщепляют только моноглицериды. Установлено, что всасывание продуктов гидролиза жира имеет свои особенности. Легко всасываются простой диффузией в слизистую кишечника спирты, АК, фосфаты, короткоцепочечные ВЖК (10-14 атомов С), азотистые основания. Труднорастворимые в воде продукты гидролиза (ВЖК, моноглицериды, холестерин, жирорастворимые витамины) всасываются только в комплексе с желчными кислотами. Эти комплексы называются холеиновыми. В таком виде эти соединения проходят через биомембраны энтероцитов. В эпителии клеток ворсинок кишечника происходит распад холинового комплекса. При этом желчные кислоты сразу поступают в ток крови и через систему воротной вены попадают в печень, откуда они вновь поступают в составе желчи в желчный пузырь и могут вновь принимать участие в новом акте переваривания жира пищи.Установлено, что общий фонд желчных кислот у взрослого человека составляет 2,8-3,5 г. При этом они совершают 5-6 оборотов в сутки за счёт печёночно-кишечной циркуляции. После того, как продукты гидролиза жира поступили в энтероциты, в стенке кишечника начинают синтезироваться жиры, специфичные для данного организма, которые по своему строению отличаются от пищевого жира.
Родоначальником желчных кислот является холевая кислота, которая содержит ОН-группу в 3, 7 и 12 положениях. Производными холевой кислоты являются: 1. хенодезоксихолевая кислота, которая имеет 2 ОН-группы в 3 и 7 положениях; 2. дезоксихолевая кислота, имеющая окси-группы в 3 и 12 положениях; 3. литохолевая кислота, имеющая одну окси-группу в 3 положении. Большая часть желчных кислот в печени конъюгирована глицином и таурином. Их еще называют парные желчные кислоты, например гликохолиевые, таурохолиевые кислоты. Соотношение конъюгатов меняется в зависимости от характера принимаемой пищи. В случае преобладания углеводов увеличивается содержание глициновых конъюгатов. Если преобладают белки в диете, то увеличивается содержание тауриновых конъюгатов. Выделение желчных кислот способствует: 1. эмульгированию жира; 2. активации панкреатических липаз, фосфолипаз; 3. способствуют всасыванию труднорастворимых в воде веществ: ВЖК, ХС, моношлицеридов, жирорастворимых витаминов. При эмульгировании жир дробится на мелкие капельки, что значительно увеличивает поверхность контакта липида с ферментами. Желчные кислоты обволакивают эти капельки, препятствуя тем самым их слиянию. Таким образом стабилизируется эмульсия жира, который будет подвергаться гидролизу под влиянием панкреатических липаз. Помогают гидролизу жира ионы Са2+, которые образуют комплекс со свободными ВЖК. [рис. гидролиза трипальмитина: трипальмитин +3 воды® (липаза) глицерин+ 3 С15Н31СООН] [рис. гидролиза фосфатидилхолина: фосфатидилхолин +4 воды®(фосфолипазы А1, А2, С, D) глицерин + С15Н31СООН + С17Н31СООН +Н3РО4 +НО-СН2- СН2-Nº(СН3) 3] Фосфолипаза А1 действует на связь между глицерином и предельной ВЖК, А2 – между глицерином и непредельной ВЖК, С – между глицерином и фосфорной кислотой, D – между фосфорной кислотой и холином (HO-CH2-CH2-N+(CH3)3). В результате гидролиза пищевого жира образуются спирты, фосфаты, ВЖК, азотистые основания, АК и другие соединения. Необходимо отметить, что в расщеплении жиров принимают участие и кишечные липазы, но их активность невысокая. К тому же они расщепляют только моноглицериды. Установлено, что всасывание продуктов гидролиза жира имеет свои особенности. Легко всасываются простой диффузией в слизистую кишечника спирты, АК, фосфаты, короткоцепочечные ВЖК (10-14 атомов С), азотистые основания. Труднорастворимые в воде продукты гидролиза (ВЖК, моноглицериды, холестерин, жирорастворимые витамины) всасываются только в комплексе с желчными кислотами. Эти комплексы называются холеиновыми. В таком виде эти соединения проходят через биомембраны энтероцитов. В эпителии клеток ворсинок кишечника происходит распад холинового комплекса. При этом желчные кислоты сразу поступают в ток крови и через систему воротной вены попадают в печень, откуда они вновь поступают в составе желчи в желчный пузырь и могут вновь принимать участие в новом акте переваривания жира пищи.Установлено, что общий фонд желчных кислот у взрослого человека составляет 2,8-3,5 г. При этом они совершают 5-6 оборотов в сутки за счёт печёночно-кишечной циркуляции. После того, как продукты гидролиза жира поступили в энтероциты, в стенке кишечника начинают синтезироваться жиры, специфичные для данного организма, которые по своему строению отличаются от пищевого жира.
|
|
18.Липопротеины. Коэффициент атерогенности. Липопротеи́ны (липопротеиды) —класс сложных белков, простетическая группа которых представлена каким-либо липидом. Делятся на:- свободные липопротеины (ЛП) – хорошо растворимые в воде вещества, транспортные формы (доминируют белки);- структурные протеолипиды – хорошо растворимые в органических растворителях.К свободным ЛП относят транспортные ЛП крови. В составе этих частиц могут быть ВЖК, триацилглицерины, фосфолипиды, холестерин, холестериды и др. Наружная часть - p-полярные соединения (гидрофильные): белки, фосфолипиды, холестерин. В центре частицы локализованы холестериды, эфиры ВЖК, триацилглицириды, фосфолипиды [рис. этого]. Все их можно разделить по плотности и по электрофоретической подвижности: 1. хиломикроны (ХМ) – самые крупные и наименее плотные (r <1»0,95 кг/л) частицы. Состоят из 2% белка и 98% липидных компонентов (триглицериды). Образуются в кишечнике. Их количество резко возрастает после приема богатой липидами пищи; 2. ЛП очень низкой плотности (ЛПОНП) – по электрофоретической подвижности эта фракция предшествует b-ЛП (пре-b-ЛП). Их плотность =0,94 – 1,006 кг/л. Содержат повышенное количество белка. Образуются в печени, осуществляют транспорт триглицеридов из нее; 3. ЛП низкой плотности (ЛПНП) – по электрофоретической подвижности b-ЛП. Плотность от 1,006 до 1,06 кг/л; 4. ЛП высокой плотности (ЛПВП) – по электрофоретической подвижности a-ЛП. Плотность от 1,06 до 1,2 кг/л. Содержат примерно 60% белка. По составу липидов, ЛП низкой и высокой плотности богаты холестерином и фосфолипидами. Биологическая роль свободных ЛП сводится к транспортным функциям. За счет их гидрофильной оболочки происходит перенос различных веществ в клетки. Также они играют важную роль в диагностике патогенеза. ЛПНП и ЛПОНП относятся к атерогенным ЛП, т.к. они богаты холестерином и являются крупными частицами, поэтому они застревают в сосудах и вызывают разрастание соединительной ткани. ЛПВП – это антиатерогены, т.к. транспорт холестерина ими происходит из клеток в ткани. Структурные липопротеины. Они плохо растворяются в воде, но хорошо в других растворителях. Участвуют в построении биомембран. Содержат 65-85% белка, находящийся в центре частицы и окружен липидами - поэтому их называют протеолипиды. В составе структурных ЛП важную роль играют фосфолипиды. Биологическая роль структурных ЛП заключается в транспорте веществ через клеточные мембраны, передаче нервного импульса и выполнении ими ферментативной функции. Коэффициент атерогенности - один из немногих интегральных показателей, позволяющий оценить риск развития атеросклероза. Для оценки состояния липидного и липопротеинного (белково-жирового) обмена определяют величины: - общего холестерина, - триглицеридов, - холестерина, входящего в состав липопротеинов высокой плотности, - холестерина, входящего в состав липопротеинов очень низкой плотности, - холестерина, входящего в состав липопротеинов низкой плотности. Определение этих величин позволяет рассчитать коэффициент атерогениости: Атерогенность = общий холестерин - холестерин, входящий в состав липопротеинов высокой плотности / холестерин, входящий в состав липопротеинов очень низкой плотности,а также другие показатели.
19. Обмен триглицеридов в тканях. Триглицериды синтезируются в клетках практически всех органах и тканей в качестве резервных питательных веществ, однако необходимо подчеркнуть, что синтез интенсивный с наибольшей интенсивностью идет в клетках печени и клетках жировой ткани, Что необходимо для синтеза триглицеридов? Для синтеза необходимы ВЖК иглицерол.ВЖК поступают в клетки или иэ плазмы крови или же синтезируются на месте, т.е. в клетках непосредственно, нз ацетилКоА. Глицерол может поступать так же из плазмы крови, однако основным источником глицерина для синтеза триглицеридов и даже фосфолипидов в клетках служит промежуточный продукт распада углеводов - ВЖК участвуют в синтезе триглицеридов в виде своих активированных производных - ацил-КоА. Необходимый для синтеза фосфоглицерин образуется или путем восстановления фосфодиоксиацетона, или же за счет фосфорилирования свободного глицерола. -Эта реакция катализируется АТФ зависимой глицеролкиназой. После образования фосфоглицерина за счет двух последовательных реакции ацилирования образуется фосфотидная кислота, затем от нее отщепляется остаток фосфорной кислоты и образуется фосфотидная кислота. И наконец в ходе последней реакции ацилировання образуется триглкцерид Этот синтез мы с вами рассматривали в качестве ресинтеза триглицеридов в стенке кишечника. За счет дегидрогиназы фосфоглицерина происходит восстановление и образование фосфорилированного глицерина. Далее идет реакция ацилирования с участием ВЖК активированных с образованием фосфатидной кислоты. Восстановление фосфодиоксиацетона в фосфоглицерол наиболее интенсивно протекает в жировой ткани, в мышцах и печени. Фосфорилирование глицерола и последующие реакции наиболее интенсивно протекают в почках, в стенках кишечника и в печени (т е. в печени есть тот и другой путь образования фосфоглицерина). Синтез резервных триглицеридов идет в основном в период всасывания продуктов пищеварения и соответственно поступление их во внутреннюю среду организма. В постадсорбцеонном периоде происходит мобилизация резервных триглицеридов. Расщепление триглицеридов в клетках идет под действием ферментов липаза. По крайней мере в липоцитах жировой ткани при распаде триглицеридов работают три различных фермента. Вначале при участии триацилглицероллипаз ы происходит гидролиз одной сложной эфирной связи образуется диглицерид и высвобождается свободная жирная кислота. Затем под действием второго фермента так же происходит гидролиз второй сложной эфирной связи и высвобождается еще одна ВЖК остается моноглицерид. С участием последней липазы происходит расщепление моноглицерида на глицерол и ВЖК, фермент - моноацилглицероллипа за. Итак трилипазы. Наименьшую активностью из этих липаз имее тпервый фермент. Поэтому активностью именного этого фермента определяется скорость гидролиза триглицерида в целом. Данный фермент является регуляторным ферментом. Активность этого фермента изменяется под влиянием ряда гормонов, таких как норадреналин, адреналин, глюкагон. Фосфорилированная триглицероллипаза активна, дефосфорилированная -неактивна.
20. Ферменты. Химическаа природа ферментов. классификация и номенклатура ферментов.Ферменты - специализированные белки обладающие каталитической активностью, т.е. способны ускорять течение химической реакции в организме человека. Химическаа природа ферментов. Изучение ферментов показало, что они обладают св-ми белков. Какие св-ва характерны для ферментов? 1) они являются амфотерными 2)осаждаются сульфатом аммония т.е. высаливаются 3) инактивируются при нагревании под действием концентрированных кислот и щелочей 4) неспособны проходить через полупроницаемые мембраны. Абсолютным доказательством белковой природы ферментов - это синтез их из отдельных аминокислот. Сегодня синтезированы из отдельных аминокислот несколько ферментов. Первыми ферментами синтезированные рибонуклеазы (ферменты расщепляющие РНК) и пепсин (основной фермент желудочного сока). Причем синтезированный рибонуклеаза и пепсин ничем не отличались по свойствам по каталитической активности от выделенных из естественных тканей. По хим. составу ферменты как и белки могут быть двух видов - простые и сложные (протеины и протеиды). Несколько слов о протеинах. Они могут состоять из одной полипептидной цепи (рибонуклеаза содержащая 124 ам. ксл. отатка, пепсин, трипсин) В то же время ряд ферментов состоят из нескольких полипептидных цепей т.е. являются олигомернымн белками. Например альдолаза - фермент гликолиза, РНК-полимераза и др. К первой группе относятся обычно класс гидролиз, практически все гадролитические ферменты состоят только из аминокислот т.е. являются простыми белками. Кроме того, некоторые лиазы, а вот все остальные классы ферментов в основном явл. сложными белками т.е. для каталитической активности многих ферментов кроме белковой части необходим второй компонент получивший название кофактор. Есть каталитически активный фермент вместе с кофактором получил название холофермент. Это каталитически активный фермент состоящий из белковой и небелковой части кофактора. Белковая часть холофермента получила название апофермент. Характерной особенностью холофермента или сложных ферментов протеидов является, то, что ни белковая часть апофермента, ни кофактор в отдельности не обладают заметной каталитической активностью. Современная классификация и номенклатура ферментов. 1) тривиальная номенклатура 2) рабочая номенклатура З) систематическая номенклатура, т.е. обычно для названия одного и того же фермента очень часто используют несколько названий, поэтому в следствии все возрастающего числа вновь открываемых ферментов было принято международное соглашение о систематической номенклатуре ферментов. В соответствии с этой системой все ферменты в зависимости от типа катализируемой реакции, я еще раз подчеркиваю что в основу положен тип катализируемых реакций, делят на 6 больших классов. В каждом классе выделяют подкласс. В подклассе выделяют под подкласс, а уже там соответственно название конкретного фермента. Шифр фермента для того что бы было понятно о каком ферменте говорит китаец если его читает русский. Например 4 буквенное обозначение 1 -ая класс, 1 подкласс, 1 под подкласс и первый порядковый номер в этом под подклассе, т.е. шифр фермента всегда включает 4-ех цифровое обозначение.Какие же классы по международному соглашению 1961 г. выделяют? а). Оксидоредуктазы - ферменты катализирующие окислительно-восстан овите льные реакции в организме человека б). Трансферазы - ферменты катализирующие реакции с переносом групп между различными веществами. Например переносящие метильную группу - метилтрансферазы, аминогруппу переносящие - аминотрансферазы и т.д. в). Гидролазы - ферменты катализирующие реакции гидролиза (гидролиз - расщепление с присоединением воды Гидролитических ферментов достаточно много. С пищей мы получаем полимеры, для того чтобы они всасывались их нужно расщепить до мономеров. г). Лиазы -1. ферменты катализирующие присоединение групп по двойной связи (имеется ввиду по месту разрыва двойной связи). 2. Разрыв углерод - углеродной связи, водородными иегидролитическим путем. Например, фермент декарбоксилаза, отщепляющая карбоксильную группу от аминокислоты, как раз относится к лиазам. д). Изомеразы - ферменты катализируют реакции изомеризации. В основном это перенос групп внутри молекул с образованием изомерных форм. Например превращение глюкозы 1- фосфат в глюкозу 6 -фосфат, т.е перенос фосфорильного остатка от первого.е). Лигазы или синтетазы - ферменты которые катализируют образование связи С-С, C-S, C-N, С-О за счет реакции конденсации сопряженных с использованием АТФ, т.е это реакции эндоорганические,тре бующи е притокаэнергии. В настоящее время идентифицировано более 2000 различ. ферментов, причем 200 из них получены и используются достаточно хорошо в кристаллическом виде. В наше время ферменты используются не только в медицине, но и в пищевой и хим. промышленности, в народном хоз-ве, для получения особо чистых препаратов (лекарств). Ферменты - специализированные белки обладающие каталитической активностью, т.е. способны ускорять течение химической реакции в организме человека. Ферменты, будучи биокатализаторами, отличаются от обычных катализаторов. Каково значение ферментов в организме человека? Ферменты по праву считают рабочим аппаратом ген. Дело в том, что как реализуют этот фермент? Все зависит от того насколько активны у вас ферменты полученные. Не секрет что сидящие здесь имеют одни и те же ферменты, но ферменты работают у каждого индивидуально. У каждого из нас поддерживается 1. Определенная концентрация ферментов. 2. Поддерживается еще и за счет синтеза активность определенных ферментов, поэтому метаболизм наш в целом очень различается. Ферменты по праву считают функциональными единицами клеточного метаболизма, поскольку большинство реакций протекающих в наших клетках (ежесекундно в наших клетках протекает десятки тысяч разнообразных химических превращений) идут с участием ферментов, за редким исключением. Только в том случае если в ходе реакции образуется какое-то неустойчивое соединение его стабилизация происходит самопроизвольно т.е. не ферментативным путем. Поэтому изучение ферментов имеет огромное значение для понимания метаболизма, для понимания патологий которые могут развиться у человека. Ферменты осуществляют превращение таким образом огромного кол-ва вещ-в, причем в-в поступающих из внешней среды и в-в образующихся в ходе метаболизма, т.е. непосредственно внутри организма. Некоторые болезни человека особенно генетически обусловленные заболевания связаны с недостаточностью или полным отсутствием того или иного фермента.
21.Переваривание белков в желудочно-кишечном тракте. Переваривание белков представляет собой расщепление пищевых белков на составляющие его аминокислоты Расщепление белков в желудочно-кишечном тракте.идет при участи фериетов протеиназ катализир гидролитическое расщепление юс гвптидных связей Все протеиназы к-к тракта могут быть разделены на 2 группы В данном случае эффективность катализа неизмеримо меньше Специфичность действия протеиназ выглядит следующим образом. Пепсин катализ разрыва летпидных связей образованных аминогруппами фенилаланина и тирозина (ароматические аминокислоты) Трипсин - катализ разрыва пептндкых связей образованных карбоксильными группами лизина и аргинина (основные аминокислоты) Хемотрипсин - кмалнз разрыва пептидных связей образованных карбоксильными группами трех аминокислот ароматических фениалаланнана, тирозина и триптофана Карбоксипептидаза А -образованных С концевыми аминокислотами фенилаланнна, тирозина и триптофана Карбоксипептидаза —образованиях С концевыми лизином и аргинином. Аланинаминопептидаза — образованных N концевым аланином В целом протеяшш ж-к тракта в отношении своей специфичности обладают дополнительностью действия т е за счет совокупности их (згаяитического эффекта с большой скоростью идет гидролиз пеПгияиых связей к белковых молекулах. Более того отсутствие одной из протеннвз за исключением трипсина обычно не приводит к существенному нарушению переваривания белков. Переваривание белков в желудке. Переваривание белков начинается в желудке В желудочном соке присутствует несколько протеиназ пепсин, гастриксин и несколько сходных с пепсином протеиназ Одним из таких ферментов является пепсин В У детей юиетея еще одна эндопротеиназа ренин Главной протеиназой желудочного свка пуослих несомненно является пепсин. Клетки слизистой дна Желудка вырабатывают профермент пепсияоген. Его молекулярная масса составляет величину килодальтон Под действием соляной кислоты желудочного сока пепсиноген в результате ограниченного протно виа превращается в пепсин молекуляр масса кот равна 32,7 килодальтон. Оптимальной средой для действия пепсина является среда с рН 1- 2,5 Это значение создается в желудке соляной кислотой. Белки под действием пепсина расщепляются в желудке с образованием смеси пептидов различной длины с очень небольшой примесью свободных аминокислот, причем пепсин обеспечивает 95 % всей переваривающей способности желудочного сока Например действие гасгрикшиа ограничено поскольку оптимум рН для этого фермента составляет величину порядка 5 Важным компонентом желудочного сока является несомненно соляная кислота, которая кроме участия в переводе пепсиногена в пепсин создает оптимум рН для действия пепсина Это так называемое значение соляной кислоты 1 перевод пепсиногена в пепсин 2, создание оптимума рН для пепсина 3. денатурирует белки 4. бактерицидное действие. Переваривание белков в кишечнике. Смесь полипептидов из желудка в 12перстнук> кишку где под действием протеиназ поджелудочного и кишечного сока продолжается расщепление белков и пеетидов до отдельных аминокислот. рН составляет от 7,5-8,2 это слабощелочное значение рН поддерживается за счет бикарбонатов поступающих в кишечник с соком поджелудочной железы. В поджелудочной железе синтезируется протоэнзимы. трипсиноген, хемотрнпсиноген, прокарбоксипептидазы А и В, проэластаза проколлагеназа С соком поджелудочной железы эти проферменты поступают в просвет кищечнкка и в результате избирательного ограниченного протиолиза превращаются в активные ферменты Важнейшую роль в превращении проферментов в ферменты принадлежит 2-м протеиназам 1 Энтерокиназа кишечной стенки 2 Трипсин Как они работают? Энтерокиназа отщепляет от неактивного трипсиногена гексопептид (6 амк остатка).превращаяпр оферм ент в активный трипсин. В дальнейшем превращение трипсиногена в трипсин может идти параллельно, путем аутокатализа. Образовавшийся трипсин превращает все другие проферменты в активные Ферменты, Хемотрипсиноген А или В под действием трипсина превращается в одну из форм активного Действие протеиназ поджелудочной железы дополняется действием ферментов синтезируемых в стенках кишечника Кишечная стенка синтезирует про аминопептидазу и про-дипептидазу. Перевод в активную форму идет так же за счет трипсина. Механизм перевода единый отщепление различной длины путем ограниченного протиолиза и фо активного центра Под действием этого комплекса ферментов белки и пептиды расщепляются до отдельных аминокислот и в таком виде всасываются в стенку кишечника. Всасывание ди-, три-, тетрапептидов абсолютно невозможно
22.Общие пути обмена аминокислот. Процессы распада аминокислот в толстом кишечнике. Общие пути превращения аминокислот включают реакции дезаминирования, трансаминирования, декарбоксилирования, биосинтеза и рацемизации. Реакции рацемизации характерны только для микроорганизмов, физиологическая роль которой заключается в синтезе D-изомеров аминокислот для построения клеточной оболочки.
· Дезаминирование (отщепление аминогруппы) - существует четыре типа реакций, катализируемых своими ферментами:
1. Восстановительное дезаминорование (+2H+)
2. Гидролитическое дезаминированиие (+H2О)
3. Внутримолекулярное дезаминирование
4. Окислительное дезаминирование (+1/2 О2)
Во всех случаях NH2- группа аминокислоты высвобождается в виде аммиака. Помимо аммиака продуктами дезаминирования являются жирные кислоты, окикислоты и кетокислоты. Для животных тканей, растений и большинства микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гистидина, который подвергается внутримолекулярному дезаминированию.
Кроме перечисленных четырех типов реакций и катализирующих их ферментов в животных тканях и печени человека открыты также три специфических фермента (серин- и треониндегидратазы и цистатионин-г- лиаза), катализирующих неокислительное дезаминирование серина, треонина и цистеина. Они требуют присутствия пиридоксаль-фосфата в качестве кофермента. Конечными продуктами реакции являются пируват и б- кетобутират, аммиак и сероводород. Известно, что микроорганизмы кишечника для своего роста также нуждаются в доставке с пищей определенных аминокислот. Микрофлора кишечника располагает набором ферментных систем, отличных от соответствующих ферментов животных тканей и катализирующих самые разнообразные превращения пищевых аминокислот. В кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот: фенола, индола, крезола, скатола, сероводорода, метилмер-каптана, а также нетоксичных для организма соединений: спиртов, аминов, жирных кислот, кетокислот, оксикислот и др. Все эти превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». Так, в процессе распада серосодержащих аминокислот (цистин, цистеин, метионин) в кишечнике образуются сероводород H2S и метил-меркаптан CH3SH. Диаминокислоты – орнитин и лизин – подвергаются процессу декарбоксилирования с образованием аминов – путресцина и кадаверина. Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальном декарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола. Микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсерная кислота или ска-токсилсерная кислота). Последние выделяются с мочой. Механизм обезвреживания этих продуктов изучен детально. В печени содержатся специфические ферменты – арилсульфотрансфераза и УДФ-глюкоронилтран-сфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы – 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы – уридил-дифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов. ФАФС и УДФГК Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индол связывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой (см. главу 18). По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гиппуровой кислоты с мочой после приема бензойной кислоты (см. главу 16). О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гиппуровой кислоты с мочой после приема бензойной кислоты Таким образом, организм человека и животных обладает рядом защитных механизмов синтеза, биологическая роль которых заключается в обезвреживании токсичных веществ, поступающих в организм извне или образующихся в кишечнике из пищевых продуктов в результате жизнедеятельности микроорганизмов.
23.Обезвреживание аммиака в оргамизме. Орнитиновый цикл мочевинообразования. Аммиак токсичен (50 мг аммиака убивает кролика, при этом [NH 3 ]=0,4-0,7 мг/л). Поэтому в тканях аммиак обезвреживается временными путями: 1) в основном – образованием амидов дикарбоновых кислот. Напр., ГЛУ + NH 3 → ГЛН (над стрелочкой "глутаминсинтетаза", под стрелочкой – АТФ → АДФ + Фн). Аналогично АСП → АСН.
 →
→ 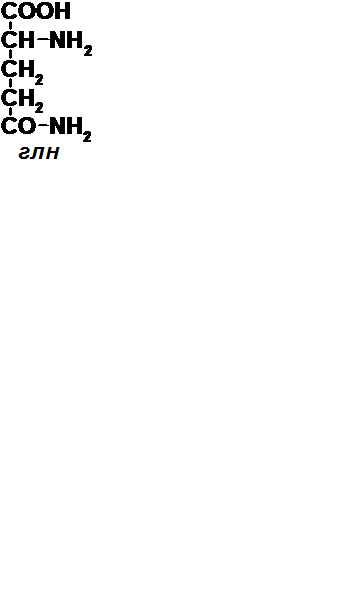
 →
→  2) восстановительное аминирование кетокислот. Этот путь и дает токсичность аммиака (из-за уменьшения кол-ва кетокислот).Такой азот (в виде конъюгатов аммиака) посупает в печень, где происходит окончательное обезвреживание аммиака – образование мочевины. Небольшое количество аминов отдают аммиак в почках, где он сразу синтезируется в мочу, где соединяется с протонами, образуя ионы аммония, которые выводятся с мочой. (В крови NH 4+ нет!) Орнитиновый цикл мочевинообразования. Мочевина содержит 80-90% всего азота мочи. В сутки образуется 25-30 г мочевины NH 2 -CO-NH 2. 1. NH 3 + CO 2 + 2АТФ + Н 2 О → H 2 N-CO-OPO 3 H 2 + 2АДФ + Н 3 РО 4 (над стрелочкой карбамоилфосфатсинтетаза). Образуется карамоилфосфат. 2. NH2-(CH2)3-CH(NH2)-COOH (это орнитин) + H2N-CO-OPO3H2 (это карбамоилфосфат) ® (орнитинкарбамоил-ТФ, – Н3РО4) NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) Далее: NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) +COOH-CH(NH2)-CH2-COOH (это АСП)® аргининосукцинатсинтетаза, АТФ→АМФ+ФФн) СООН-СН2-СН(СООН)-NH-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргининосукцинат) ®(аргининосукцинатлиаза) СООН-СН=СН-СООН (это фумарат, который идете в ЦТК)) +NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин). Затем: NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин)® (аргиназа, +Н2О) NH2-C(=O)-NH2 (это мочевина) + NH2-(CH2)3-CH(NH2)-COOH (это орнитин)Т.о., для синтеза мочевины необходимо два азота – один из АСП и один из ГЛУ, ГЛН, АЛА; а также 3 АТФ и 1 СО 2.
2) восстановительное аминирование кетокислот. Этот путь и дает токсичность аммиака (из-за уменьшения кол-ва кетокислот).Такой азот (в виде конъюгатов аммиака) посупает в печень, где происходит окончательное обезвреживание аммиака – образование мочевины. Небольшое количество аминов отдают аммиак в почках, где он сразу синтезируется в мочу, где соединяется с протонами, образуя ионы аммония, которые выводятся с мочой. (В крови NH 4+ нет!) Орнитиновый цикл мочевинообразования. Мочевина содержит 80-90% всего азота мочи. В сутки образуется 25-30 г мочевины NH 2 -CO-NH 2. 1. NH 3 + CO 2 + 2АТФ + Н 2 О → H 2 N-CO-OPO 3 H 2 + 2АДФ + Н 3 РО 4 (над стрелочкой карбамоилфосфатсинтетаза). Образуется карамоилфосфат. 2. NH2-(CH2)3-CH(NH2)-COOH (это орнитин) + H2N-CO-OPO3H2 (это карбамоилфосфат) ® (орнитинкарбамоил-ТФ, – Н3РО4) NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) Далее: NH2-CO-NH-(CH2)3-CH(NH2)-COOH (это цитруллин) +COOH-CH(NH2)-CH2-COOH (это АСП)® аргининосукцинатсинтетаза, АТФ→АМФ+ФФн) СООН-СН2-СН(СООН)-NH-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргининосукцинат) ®(аргининосукцинатлиаза) СООН-СН=СН-СООН (это фумарат, который идете в ЦТК)) +NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин). Затем: NH2-C(=NH)-NH-(CH2)3-CH(NH2)-COOH (это аргинин)® (аргиназа, +Н2О) NH2-C(=O)-NH2 (это мочевина) + NH2-(CH2)3-CH(NH2)-COOH (это орнитин)Т.о., для синтеза мочевины необходимо два азота – один из АСП и один из ГЛУ, ГЛН, АЛА; а также 3 АТФ и 1 СО 2.