I. Изучение нового материала
1. Определение процесса
2. История открытия закона
3. Формула и формулировка закона
4. Графическое изображение
1. Изотермический процесс – процесс изменения состояния термодинамической системы при постоянной температуре.
Для идеального газа изотермический процесс описывается законом Бойля-Мариотта. Закон установлен экспериментально до создания молекулярно-кинетической теории газов английским физиком Робертом Бойлем в 1662 году и французским аббатом Эдмоном Мариоттом, который описал независимо от Бойля аналогичные опыты в 1676 году.
Закон Бойля-Мариотта (изотермический процесс, T=const)
| m = const, T = const pV = const |
Для газа данной массы при постоянной температуре произведение давления на объем постоянно.
р р V
Т1>Т2
Т1
Т2
0 V 0
Т 0 Т
изотермы
Закон Бойля-Мариотта справедлив для любых газов, а так же и для их смесей, например, для воздуха. Лишь при давлениях, в несколько сотен раз больших атмосферного, отклонения от этого закона становятся существенными.
Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Однако газовые законы активно работают не только в технике, но и в живой природе, широко применяются в медицине.
Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
При дыхании межреберные мышцы и диафрагма периодически изменяют объем грудной клетки. Когда грудная клетка расширяется, давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и в следствие образовавшегося перепада давлений происходит вдох. Другими словами воздух идет из
окружающей среды в легкие самотеком до тех пор, пока величины давления в легких и в окружающей среде не выравняются.
Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
2. Изобарный процесс – процесс изменения состояния термодинамической системы, протекающий при постоянном давлении.
Для идеального газа изобарный процесс описывается законом Гей-Люссака.
Закон установлен в 1802 году французским физиком Гей-Люссаком, который определял объем газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально.
Закон Гей-Люссака (изобарный процесс p=const)
| m = const, p = const V = const T |
Для газа данной массы при постоянном давлении отношение объема к температуре постоянно.
V p1 p p p2
p1<p2
0 T 0 T 0 V
изобары
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
3. Изохорный процесс – процесс изменения состояния термодинамической системы, протекающий при постоянном объеме.
Для идеального газа изохорный процесс описывается законом Шарля.
В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.
Закон Шарля (изохорный процесс, V=const)
| m = const, V = const p = const T |
Для газа данной массы при постоянном объеме отношение давления к температуре постоянно.
p V1 V pV2
V1<V2
0 T 0
T 0 V
изохоры
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
II. Применение полученных знаний для решения задач.
1. Даны графики процессов в различных системах координат
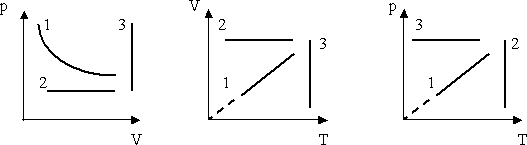
Найти во всех трех системах координат:
a. Изотермы;
b. Изохоры;
c. Изобары.
2. Чем отличаются состояния А и Б газа данной массы (рис.)?
р
А Б
0 Т
3. При температуре 27оС давление газа в закрытом сосуде было 75кПа. Каким будет давление этого газа при температуре – 13оС?
| Дано: | Решение: | |
| V=const | По закону Шарля: р/Т=const. | |
| t1=27oC | 300oK | р1/Т1= р2/Т2, |
| p1=75кПа | 75∙103Па | р1Т2=р2Т1, |
| t2=-13oC | 263oC | р2=р1Т2/Т1, |
| p2 –? | р2=75∙103∙263/300=65кПа. | |
| Ответ: 65кПа. |