| Температура опыта, оС | Время помутнения, с | Относительная скорость реакции, υ=1:τ, с-1 | Температурный коэффициент скорости реакции, γ | |
| теоретический | экспериментальный | |||
| Т1 =5 | τ 1 =110 | υТ1=0,009 | 1,80 | 1,72 |
| Т2 =25 | τ 2 =35 | υТ2=0,028 |
Рассчитаете относительную скорость реакции при температуре Т1 (υТ1)и Т2 (υТ2),температурный коэффициент «γ» (формула 2.5) и заполните таблицу 2.2.
С повышением температуры скорость реакции резко увеличивается. Зависимость скорости реакции от температуры приближенно описывается эмпирическим правилом Вант-Гоффа. При повышении температуры на каждые 10 скорость реакции увеличивается в 2-4 раза.
Что характеризует «γ»? Сравнив экспериментальное значение температурного коэффициента с теоретическим значением, оцените точность эксперимента.
Температурный коэффициент скорости реакции показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 градусов.
Пример 2.6. Температурный коэффициент реакции равен 3. При охлаждении сис-
темы от 500 С до300 скорость химической реакции …
1) уменьшится в 9 раз 2) увеличится в 9 раз 3) уменьшится в 6 раз 4) не изменится
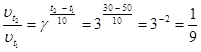 . Правильный ответ: уменьшится в 9 раз.
. Правильный ответ: уменьшится в 9 раз.
Пример 2.7. Образец СаСО3 растворяется в соляной кислоте при 200С в течение 6 минут, при 40 0С – за 40 секунд. Температурный коэффициент реакции равен …
1) 2 2) 2,53) 3 4) 4
6 минут составляет 360 секунд. Температура увеличилась на 20 0С, скорость увеличилась в (360: 40) = 9 раз. При изменении температуры на 10 0С скорость увеличится в три раза, т.е. температурный коэффициент равен трём.
Упражнение 2.10. Если температурный коэффициент реакции карбоната магния с кислотой равен 3 и при температуре 25оС она заканчивается за 36 минут, то при температуре 45оС время завершения будет равно _______ минут(ы).
Воспользуемся правилом Вант-Гоффа: k2 = k1 * γ((t2-t1)/10), где k1,2 - константа скорости реакции, y - температурный коэффициент реакции, t1,2 - температура.
k2 = k1 * γ((45-25)/10) = 9k1.
Значит при 45° реакция закончится в 9 раз быстрее, то есть, за 36/9 = 4 минут.
1) 3 2) 4 3) 6 4) 8
Правильный ответ: 2
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Основные факторы, от которых зависит скорость химических реакций:
1) природа реагирующих веществ и температура
2) в растворах: природа и концентрация реагирующих веществ, температура, присутствие катализатора
3) в газообразной системе: парциальные давления участников реакции, температура, присутствие катализатора 4) концентрация реагирующих веществ и температура.
Укажите ответ, наиболее полно отвечающий на поставленный вопрос.
Правильный ответ: 2 и 3
2. Если увеличить давление в 10 раз, то скорость прямой реакции
H2(газ) + Br2(газ)↔2HBr(г),
при условии ее элементарности, увеличится в ____ раз.1) 50 2) 100 3) 20 4) 5
Правильный ответ: 2
3. Если скорость реакции увеличилась в 8 раз при повышении температуры на 30 0С, то температурный коэффициент скорости равен ….. 1) 9 2) 3 3) 2 4) 8
Правильный ответ: 3
2.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить;
· лекцию «Химическое равновесие» [Конспект лекций, раздел 2.3];
· видеозапись лабораторной работы «Химическое равновесие» [Приложение к УМК: диск 1, работа 2].
Цель выполнения задания
· Усвоить механизм установления химического равновесия и его отличительные признаки.
· Рассмотреть влияние внешних условий на смещение химического равновесия.
Теоретические сведения
Большинство химических процессов обратимы, т.е. наряду с прямой реакцией, по мере накопления продуктов реакции, начинает идти обратный процесс.Состояние равновесия наступает в тот момент, когда скорость прямой реакции станет равной скорости обратной реакции. Химический процесс при этом не прекращается, но концентрации всех веществ не меняются, называются равновесными и в кинетическом уравнении записываются в квадратных скобках.
Константа химического равновесия представляет собой отношение константы скорости прямой реакции к константе скорости обратной реакции, а также отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа химического равновесия зависит от температуры и природы реагирующих веществ, но не зависит от концентрации.
Если под воздействием внешних факторов (изменения концентрации реагирующих веществ, температуры, давления) скорость прямой и обратной реакции изменяется в разной степени, то химическое равновесие нарушается (смещается):
а) при увеличении концентрации исходных веществ химическое равновесие смещается в сторону образования продуктов реакции, а при увеличении концентрации продуктов, химическое равновесие смещается к исходным веществам;
б) при увеличении внешней температуры химическое равновесие смещается в сторону эндотермической реакции (ΔrН > 0), а при уменьшении температуры − в сторону экзотермической реакции (ΔrН< 0);
в) при увеличении внешнего давления химическое равновесие смещается в сторону образования меньшего числа моль газов, т.е. в сторону понижения давления, при уменьшении внешнего давления − в сторону большего числа моль газов, т.е. в сторону повышения давления.
Общий принцип, определяющий влияние различных факторов на равновесие системы, называется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Влияние изменения концентрации реагирующих веществ
на смещение химического равновесия
Реакция между хлоридом железа (III) и роданидом калия идет с образованием окрашенного в интенсивно красный цвет роданида железа (III) и является обратимой:

 FeCl3 + 3 KCNS Fe(CNS)3 + 3 KCl.
FeCl3 + 3 KCNS Fe(CNS)3 + 3 KCl.
красный цвет
При увеличении скорости прямой реакции увеличивается количество образовавшихся продуктов реакции (Fe(CNS)3 и KCl и окраска раствора становится более интенсивной. Наоборот, при увеличении скорости обратной реакции окраска раствора становится менее интенсивной, т.к. увеличивается концентрация исходных веществ.
Схема проведения эксперимента и полученные результаты представлены на рис. 2.4.
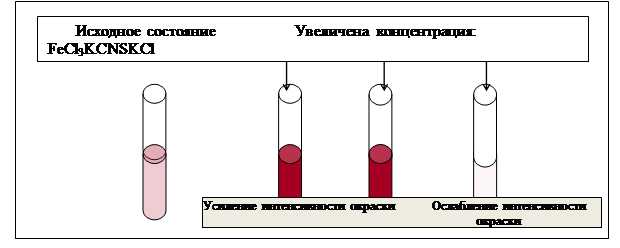
Рис. 2.4. Схема проведения эксперимента по изучению влияния изменения концентрацииреагирующих веществ на смещение химического равновесия
В пробирку, на три четверти заполненную дистиллированной водой, вносится по 3–4 капли растворов хлорида железа и роданида калия. Содержимое перемешивается и делится на четыре пробирки. В первую пробирку добавляются 2–3 капли раствора FeCl3, во вторую столько же раствора KCNS, в третью – на кончике шпателя кристаллический KCl, четвертую пробирку оставляют для сравнения. Данные эксперимента внесите в таблицу 2.3.
Таблица 2.3
Смещение химического равновесия
| Добавленное вещество | Изменение интенсивности окраски (усиление или ослабление) | Направление смещения равновесия |
| FeCl3 | Усиление | Прямого процесса |
| KCNS | Усиление | Прямого процесса |
| KCl | Ослабление | Обратной реакции |
В сторону какого процесса: прямого или обратного, смещается равновесие при увеличение концентрации: а) исходных веществ, б) продуктов реакции? Соответствует ли это принципу Ле Шателье? Является ли это противодействием на внешнее воздействие?
При увеличении концентрации исходных веществ возрастает скорость прямой реакции и равновесие смещается вправо. При уменьшении концентрации исходных веществ, наоборот, возрастает скорость обратной реакции, а химическое равновесие смещается влево.
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, и наоборот).
Увеличение температуры, как правило, увеличивает скорость и прямой, и обратной реакции, но при этом скорость эндотермической реакции возрастает в большей степени, чем скорость экзотермической реакции. Соответственно, при охлаждении системы скорости прямой и обратной реакций уменьшаются, но тоже не в одинаковой степени: для экзотермической реакции существенно меньше, чем для эндотермической.
Влияние температуры на смещение химического равновесия
Все химические реакции сопровождаются образованием новых веществ, т.е. изменением природы участников реакции, а потому либо выделением теплоты (ΔrН< 0 – реакция экзотермическая), либо поглощением теплоты (ΔrН > 0 – реакция эндотермическая). Если прямая реакция идет с выделением теплоты, то обратная – с поглощением.
Реакция йода с крахмалом сопровождается образованием окрашенного в синий цвет соединения. Схема проведения эксперимента и полученные результаты представлены на рис. 2.5.
В пробирку наливается 2 – 3 мл раствора крахмала и добавляется несколько капель раствора йода. Наблюдается образование соединения синего цвета. При нагревании пробирки окраска раствора исчезает, а при охлаждении – появляется. Таким образом, наблюдается смещение равновесия
 охлаждение извне
охлаждение извне
(С6Н10О5) x + x J2 (С6Н10О5) x · x J
 нагревание извне соединение синего цвета
нагревание извне соединение синего цвета
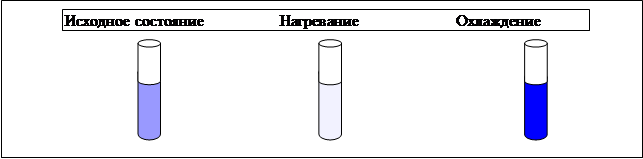
Рис. 2.5. Схема проведения эксперимента по изучению влияния изменения температуры на смещение химического равновесия
Используя принцип Ле Шателье, определите, с выделением или поглощением теплоты идет прямая реакция.
Укажите, в сторону какого процесса (экзотермического или эндотермического) смещается химическое равновесие: а) при повышении температуры, б) при понижении температуры.
При увеличении температуры (т.е. при нагревании системы) равновесие смещается в сторону протекания эндотермической реакции, а при ее уменьшении (т.е. при охлаждении системы) – в сторону протекания экзотермической реакции. (Если прямая реакция является экзотермической, то обратная обязательно будет эндотермической, и наоборот).
Пример 2.8. Каким изменением внешних условий можно повысить полноту сгорания угля
2С (кристалл.) + О2 (газ)<══> 2СО (газ); ∆rН<О?
Решение. Для увеличения полноты сгорания угля необходимо, чтобы скорость прямой реакции стала больше, чем скорость обратной реакции.
Концентрация кислорода в ходе прямого процесса уменьшается, поэтому для увеличения скорости этого процесса концентрацию кислорода следует увеличивать.
В процессе сгорания угля теплота выделяется в окружающую среду (∆rН <О), поэтому внешнее воздействие на систему должно состоять в понижении температуры окружающей среды.
Давление в системе в результате прямого процесса увеличивается (из одного моль газа О2 образуется два моль газообразного СО). Скорость прямого процесса будет больше, чем скорость обратного процесса при условии удаления из системы продукта реакции, что может произойти в том случае, если давление в окружающей среде станет меньше, чем в равновесной системе.
Таким образом, полноту сгорания угля можно повысить, если в среде, окружающей равновесную систему, понизить температуру и давление и ввести дополнительное количество кислорода.
Следовательно, для смещения равновесия в нужную сторону, внешний фактор (P, C, T) должен измениться противоположно тому, как это происходит в ходе данного процесса.
Пример 2.9. Уменьшение углекислого газа в системе
СаСО3(твёрд.) ↔ СаО(твёрд.) + СО2(газ)
приведет к…
1) увеличению содержания исходных веществ
2) уменьшению содержания продуктов и исходных веществ
3) увеличению содержания продуктов реакции
4) состояние равновесия не изменится
Удаление из системы продукта реакции (СО2) приведёт к уменьшению скорости обратной реакции и равновесная система ответит противодействием − образованием дополнительного количества СО2, т.к. скорость прямой реакции станет больше скорости обратной реакции. Правильный ответ 3.
Упражнение 2.11. Равновесие в системе
2NH3(газ) + СO2(газ) ↔ СO(NH2)2(жидк.)+ H2O(жидк.)
сместится в сторону продуктов реакции при…
□ 1) увеличении общего давления□ 2) уменьшении парциального давления СО2
□3) уменьшении концентрации СO(NH2)2□ 4) добавлении воды
Правильные ответы поясните на основании принципа Ле Шателье.
принцип Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
Правильный ответ 1.
Пример 2.10. Для увеличения выхода продуктов реакции
O2(г.) + 4HCl(г) ↔ 2Cl2(г.) +2H2O(г.), ∆rН< 0 необходимо…
1) повысить давление и повысить температуру
2) повысить давление и понизить температуру
3) понизить давление и понизить температуру
4) понизить давление и повысить температуру
В ходе прямого процесса в системе: Т−↑, р−↓. Температура увеличивается, т.к. прямой процесс идёт с выделением теплоты; давление уменьшается, поскольку из 5-и моль газообразных веществ образуется 4 моль газа.
В соответствии с принципом Ле Шателье, внешнее воздействие должно быть противоположно изменениям параметров в равновесной системе: Т − ↓, р − ↑.
Правильный ответ 2.
Упражнение 2.12. Равновесие в системе
O2(газ) + 4HCl(газ) ↔ 2Cl2(газ) +2H2O(газ), ∆rН< 0
сместится в сторону исходных веществ …
□ 1) при уменьшении общего давления□ 2) при увеличении общего давления
□ 3) при увеличении температуры □ 4) при увеличении концентрации О2
Правильные ответы поясните на основании принципа Ле Шателье.
принцип Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие». Реакция экзотермическая.
Правильный ответ 3.
Упражнение 2.13. Равновесие в системе
SO3(газ)+ C(кристалл.) ↔ SO2 (газ) + CO(газ), ∆rН> 0
сместится в сторону продуктов реакции …
□ 1) при увеличении температуры □ 2) при увеличении парциального давления СО
□ 3) при уменьшении общего давления□ 4)при уменьшении концентрации SО3
Правильные ответы поясните на основании принципа Ле Шателье.
принцип Ле-Шателье: «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию одного или нескольких веществ, участвующих в реакции), то это приведет к увеличению скорости той реакции, протекание которой будет компенсировать (уменьшать) оказанное воздействие».
∆Η˃0, значит реакция эндотермическая, температуру надо повышать был 1 моль газа, а стало 2 моля газов, значит давление надо уменьшить
Правильный ответ 1 и 3.
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
4. Равновесие в системе PCl3(газ) + Cl2 (газ) <==>PCl5(пар) ; ΔrH = 113 кДж
сместится в сторону исходных веществ …
□ 1) при уменьшении общего давления□ 2) при увеличении общего давления
□ 3) при уменьшении температуры □ 4) при увеличении концентрации Cl2
Правильный ответ 2 и 4.
5. Равновесие в системе ZnO(кристалл.) + CO(газ)<==>Zn(кристалл.) + CО2 (газ), ∆ rH> 0 сместится в сторону исходных веществ
□ 1) при увеличении общего давления □ 2)при уменьшении температуры □ 3)при увеличении парциального давления СО2□ 4) при увеличении температуры
Правильный ответ 2 и 3