Задачи 2.1 – 2.3
Таблица 2.1
| N варианта | ρн1, кг/м3 | ρн2, кг/м3 | t, грС | ρг, кг/м3 | Го, м3/м3 | υн1*104, м2/с |
| 1.4 | 0.3250 | |||||
| 0.8 | 37.5500 | |||||
| 1.2 | 69.0000 | |||||
| 0.9 | 1.6330 | |||||
| 0.7 | 0.4030 | |||||
| 0.8 | 0.0514 | |||||
| 1,1 | 0.248 | |||||
| 0,8 | 1.388 | |||||
| 0,7 | 0.585 | |||||
| 0.638 |
- ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПЛАСТОВЫХ И ТЕХНИЧЕСКИХ ВОД
Пластовые воды нефтяных месторождений это неотъемлемая часть продукции добывающих скважин, которая обусловливает значительную долю осложнений при добыче и подготовке нефти на промыслах.
Пластовые воды нефтяных месторождений, как правило, представляют собой сложные многокомпонентные системы. Обычно они содержат ионы растворимых солей:
- анионы OH(-), CL(-), SO42(-), CO32(-), HCO3(-),
- катионы H(+), K(+), Na(+), NH4(+), Mg2(+), Ca2(+), Fe2(+), и др.
- ионы микроэлементов: Br(-), J(-), и др.
- коллоидные частицы: SiO2, Fe2O3, Al2O3;
- растворенные газы: CO2, H2S, CH4, H2, N2 и др.
- нафтеновые кислоты и их соли.
Количественные соотношения между этими ионами определяют тип пластовых и сточных вод.
Из физических свойств пластовой и сточной вод наибольшее значение в процессах сбора и подготовки имеют плотность и вязкость ее. Плотность пластовой (минерализованной) воды в зависимости от солесодержания может быть в первом приближении рассчитана по формуле
ρвп = ρв + 0.7647S, (3.1)
где ρв — плотность дистиллированной воды при 20 оС, кг/м3; S –концентрация соли в воде (растворе), кг/м3.
В диапазоне температур от 0 до 45 оС плотность водных растворов солей нефтяных месторождений изменяется мало, поэтому в первом приближении влияние температуры может быть учтено следующим образом:
ρвп(T) = ρвп - 0.0714(t - 20), (3.2)
где ρвп(t), ρвп — плотность минерализованной воды при температуре t и 20 оС соответственно, кг/м3.
Важное значение имеет возможность учета изменения вязкости попутной воды при изменении ее температуры, солесодержания и, как следствие, плотности. Как показывает обработка экспериментальных данных, в первом приближении вязкость минерализованной воды может быть рассчитана следующим образом:
при ∆ρ =< ∆ρ1 μвп = μв(t) * 10 0.8831∆ρ * 10 -3, (3.3)
где μвп — вязкость пластовой воды при температуре t, мПа*с; μв(t) — вязкость дистиллированной воды при температуре t, мПа*с; значение ее может быть определено по справочнику или по формуле
μв(t) = 1353*(t + 50) -1.6928, (3.4)
где ∆ρ разность между плотностью минерализованной и дистиллированной вод
при 20 оС, кг/м3;
∆ρ = ρвп - 998.3, (3.5)
где ρвп — плотность минерализованной воды при 20 оС, кг/м3; ∆ρ1 — параметр, определяемый по формуле
∆ρ1 = 0.793*(146.8 - t) (3.6)
при ∆ρ > ∆ρ1
μвп = μв(t)*10(10-3*A(ρ)) (3.7)
где А (ρ) — функция, значения которой зависят от температуры и плотности
при 0 =< t =< 20 оС
A(ρ) = 2.096*(∆ρ - 0.5787*∆ρ1), (3.8)
при 20 < t =< 30 оС
A(ρ) = 2.096*(∆ρ - 0.5787*∆ρ1) - 0.032*(t - 20)*(∆ρ - ∆ρ1) (3.9)
при t > 30 оС
A(ρ) = 1.776*(∆ρ - 0.503*∆ρ1) (3.10)
ТИПОВЫЕ ЗАДАЧИ
ТИПОВАЯ ЗАДАЧА 3.1
Температура попутной воды в технологическом процессе последовательно принимает значения 0, 15, 25, 33 и 45 оС, а солесодержание ее равно 200 г/л. Определить изменение плотности и вязкости минерализованной воды в технологическом процессе.
Дано: S = 200 г/л; t = 0, 15, 25, 33, 45 оС
Найти: ρвп(t) =?, μвп(t) =?
Решение:
ρвп = ρв + 0.7647*S
при 20 оС ρвп = 998.3 + 0.7647 * 200 = 1151 кг/л
при 0 оС ρвп(0) = 1151 - 0.0714(0 - 20) = 1152 кг/л
Рассчитываем параметр ∆ρ1
∆ρ1(t) = 0.793 * (146.8 - t)
∆ρ1(0) = 0.793 *(146.8 - 0) = 116.4 кг/м3
∆ρ = ρвп - 998.3
∆ρ = 1151 - 998.3 = 152.7 кг/м3
Так как 152.6 > 116.4 μвп = μв(t) * 10 (10 - 3 * A(ρ))
A(ρ) = 2.096 * (∆ρ - 0.5787 * ∆ρ1)
A(ρ) = 2.096 * (152.7 - 0.5787 * 116.4) = 178.87
μв(0) = 1353 * (0 + 50) - 1.6928 = 1.8 мПа*с
μвп(0) = 1.8 * 10 (178.87 * 10 - 3) = 2.72 мПа*с
Результаты аналогичных расчетов для других заданных температур помещены в таблицу.
РЕЗУЛЬТАТЫРЕШЕНИЯ ЗАДАЧИ 3.1
Таблица 3.1
| t оС | ρвп кг/м3 | ∆ρ1 кг/м3 | μв(t) мПа*с | А(ρ) мПа*с | μвп(t) |
| 116,4 | 1,8 | 178,87 | 2,72 | ||
| 104,5 | 1,15 | 193,31 | 1,79 | ||
| 96,6 | 0,91 | 193,91 | 1,42 | ||
| 90,2 | 0,76 | 190,62 | 1,18 | ||
| 80,7 | 0,61 | 199,1 | 0,96 |
Из результатов следует, что вязкость уменьшилась почти в 3 раза, а плотность - на 3 кг/м3 при изменении температуры от 0 до 45 оС.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫПО ТЕМЕ «ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПЛАСТОВЫХ И
ТЕХНИЧЕСКИХ ВОД»
ЗАДАЧА 3.1
Температура попутной воды в технологическом процессе последовательно принимает ряд значений. Определить изменение плотности и вязкости минерализованной воды в технологическом процессе при известном ее солесодержании.
Исходные данные к задаче 3.1
Таблица 3.2
| Параметры | Номер варианта | ||||||||||||
| S, г/л | |||||||||||||
| Т1, оС | |||||||||||||
| Т2, оС | |||||||||||||
| Т3, оС |
- РАСЧЕТЫРАЗГАЗИРОВАНИЯ НЕФТЕЙ
При нарушении равновесия в системе пар-жидкость вследствие изменения температуры или давления начинается перераспределение углеводородов между фазами, которое происходит до тех пор, пока парциальные давления каждого компонента в паровой и жидкой фазах не сравняются.
Константой фазового равновесия или, точнее, коэффициентом распределения i-го компонента между паровой и жидкой фазами называется отношение упругости паров индивидуального углеводорода Qi к давлению смеси Рсм или отношение молярной доли i-го компонента в паровой фазе Niv к молярной доле его в жидкой фазе Nil, находящейся в равновесии с паровой фазой:
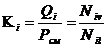 , (4.1)
, (4.1)
где Кi — константа равновесия i-го компонента при данных термодинамических условиях.
Константы фазового равновесия определяются экспериментально или расчетными методами и собраны в таблицах (см табл.в приложении) или представлены в виде номограмм.
Общее число молей n исходной смеси равно числу молей паровой nv и жидкой nl фаз:
 (4.2)
(4.2)
Причем,
 (4.3)
(4.3)
где NV и NL — молярные доли паровой и жидкой фаз, соответственно.
 (4.4)
(4.4)
Из этого уравнения и формулы для Кi получаются уравнения фазовых концентраций, позволяющие определять концентрацию компонентов в фазах при заданных давлении, температуре, исходном составе смеси и константах фазового равновесия:
 , (4.5)
, (4.5)
 . (4.6)
. (4.6)
В этих уравнениях, которые и нужны для расчета состава нефти (NiL) и состава отсепарированного газа (NiV), неизвестен параметр NV, молярная доля паровой фазы.
Молярная доля паровой фазы определяется из следующих соотношений:
 , (4.7)
, (4.7)
где n – число компонентов смеси.
Тогда из уравнений фазовых концентраций с учетом последнего равенства справедливо будет записать:
 . (4.8)
. (4.8)
Это выражение называется уравнением фазовых равновесий.
Решая уравнение фазовых равновесий методом последовательных приближений, находим такое значение NV, при котором
 . (4.9)
. (4.9)
Затем по уравнениям фазовых концентраций, зная NV, находим молярный состав фаз.
Таким образом, алгоритм решения задачи на расчет равновесных составов нефти и газа при сепарации следующий:
· Определяем по таблице константы фазового равновесия для заданных давления и температуры сепарации для каждого компонента нефтегазовой смеси;
· Дальнейший расчет проводим в программе EXCELL:
· Решаем уравнение фазового равновесия методом последовательных приближений, т.е. последовательно задаваясь произвольными значениями NV – мольной долей газовой фазы, добиваемся, чтобы значение правой части уравнения по абсолютной величине было меньше 0.003.
· Используя уравнения фазовых концентраций и подобранное значение NV, рассчитываем молярный состав жидкой и паровой фазы. Проверкой правильности решения служит выполнение следующих соотношений:
 . (4.10)
. (4.10)
Пример расчета фазового равновесия приведен в приложении.
· Исходя из молярного состава рассчитываем требуемые свойства фаз (молекулярную массу, плотность и другие).
· Количество нефти и отсепарированного газа: рассчитываем число молей исходной смеси углеводородов:
 . (4.11)
. (4.11)
· Зная NV, а значит и NL, рассчитываем число молей нефти и число молей газа:
 (4.12) / (4.13)
(4.12) / (4.13)
· Зная число молей и молекулярную массу фазы, можно рассчитать количество каждой фазы:
 . (4.14) / (4.15)
. (4.14) / (4.15)
ТИПОВАЯ ЗАДАЧА 4.1.
Рассчитать равновесные составы нефти и газа в газожидкостной смеси, поступающей в сепаратор при давлении 0.3 МПа и температуре 38 оС, если известен состав пластовой нефти (молярные доли): азот - 0.001, метан - 0.3298, этан - 0.0345, пропан - 0.0702, изобутан - 0.019, бутан - 0.0467, изопентан - 0.0166, пентан - 0.0249, гексан + высшие - 0.083 и нелетучая часть - 0.3743.
Решение:
По таблицам из Приложения определить константы фазового равновесия при давлении 0.3 МПа и температуре 38 оС.
Для заданного состав смеси при известных константах фазового равновесия по уравнению (4.8) найти молярную долю NV газообразной фазы в смеси, а по уравнениям (4.5) и (4.6) рассчитать, соответственно, составы равновесных жидкости (NiV) и газа (NiL).
Для этого задаемся произвольными молярными долями газообразной фазы в смеси. Например, первое приближение Nv = 0.5. Затем, используя данные о составе смеси, рассчитывают значение левой части уравнения (4.8). В результате вычислений, при молярных долях газообразной фазы в смеси Nv = 0.5, 0.4, 0.475, 0.47, 0.46, 0.465, 0.4655,0.467, 0.466 получены соответственно следующие значения левой части уравнения 0.0, -0.1074, 0, 2151, -0.0284, -0.0126, 0.0191, 0.0032, 0.0017, -0.0042, 0.000077.
Принимаем как окончательное значение Nv = 0.466.
Так как исходный состав пластовой нефти, как правило, содержит погрешность, то при решении (4.8) вполне можно ограничиться приближением, при котором абсолютная величина значения правой части уравнения (4.8) отличается от нуля не более, чем на 0.003, что позволяет сократить объем вычислительной работы.
Результаты расчета равновесных составов газообразной и жидкой фаз по (4.5) и (4.6) представлены в таблице 4.1.
Расчет количества образовавшихся фаз показан в типовой задаче 4.2.
РАВНОВЕСНЫЕ СОСТАВЫСМЕСИ НЕФТИ И ГАЗА ПРИ 0.3 МПА И 38 ОС
Таблица 4.1
| Компоненты | Молярные составы нефти и газа при различных приближениях | |||||
| Nv = 0.465 | Nv = 0.466 | Nv = 0.467 | ||||
| Nil | Niv | Nil | Niv | Nil | Niv | |
| N2 | 8*10-6 | 0,0021 | 8*10-6 | 0,0021 | 8*10-6 | 0,0021 |
| CH4 | 0,011 | 0,6965 | 0,011 | 0,6952 | 0,0109 | 0,6937 |
| C2H6 | 0,0052 | 0,0682 | 0,0052 | 0,0681 | 0,0052 | 0,068 |
| C3H8 | 0,0296 | 0,1169 | 0,0296 | 0,1168 | 0,0295 | 0,1166 |
| i-C4H10 | 0,0148 | 0,0238 | 0,0148 | 0,0238 | 0,0148 | 0,0238 |
| C4H10 | 0,0431 | 0,0508 | 0,0431 | 0,0508 | 0,0431 | 0,0508 |
| i-C5H12 | 0,0218 | 0,0107 | 0,0218 | 0,0107 | 0,0218 | 0,0107 |
| C5H12 | 0,0343 | 0,0141 | 0,0343 | 0,0141 | 0,0344 | 0,0141 |
| C6H14 | 0,1394 | 0,0181 | 0,1396 | 0,0181 | 0,1398 | 0,0182 |
| C7H16+В | 0,6996 | 0,7009 | 0,7023 | |||
| Итого | 0,9988 | 1,0013 | 1,0003 | 0,9997 | 1,0018 | 0,998 |
Пример оформления решения задачи на расчет фазового равновесия нефть-газ в EXCEL:
Таблица 4.2
| Компоненты | Молярный состав пластовой нефти, Ni(L+V) | Молекулярная масса компонентов, г/моль | Константы равновесия при Р=0,6 МПа, t=20 ОС | Молярный состав продуктов сепарации | бор NV | |
| Нефть, NiL | Газ, NiV | |||||
| СН4 | 0,2671 | 0,034706 | 0,867658 | 0,8329522 | ||
| С2H6 | 0,0182 | 0,006731 | 0,047120 | 0,0403889 | ||
| С3Н8 | 0,0375 | 1,4 | 0,033735 | 0,047229 | 0,0134941 | |
| i-C4H10 | 0,0152 | 0,56 | 0,017327 | 0,009703 | -0,007624 | |
| n-C4H10 | 0,0352 | 0,38 | 0,042562 | 0,016173 | -0,026389 | |
| i-C5H12 | 0,0183 | 0,16 | 0,023901 | 0,003824 | -0,020077 | |
| n- C5H12 | 0,0262 | 0,12 | 0,034460 | 0,004135 | -0,030326 | |
| C6H14 | 0,0729 | 0,04 | 0,099568 | 0,003982 | -0,095586 | |
| C7+ ВЫСШИЕ | 0,5074 | 0,703744 | -0,703745 | |||
| 0,996738 | 0,999827 | 0,0030892 | ||||
| Сумма = 1 | NV = 0,279 | |||||
| NL = 0,721 |
Продолжение таблицы 4.2:
| Молекулярная масса смеси, Мсм | Число молей исходной смеси, nсм | Число молей нефти, nн | Число молей газа, nг | Молекулярная масса нефти, Мн | Молекулярная масса газа, Мг | Количество нефти, Gн, т/сут | Количество газа, Gг, т/сут | Заданный расход смеси, т/сут |
| 4,27 | 0,55 | 13,88 | ||||||
| 0,54 | 0,20 | 1,41 | ||||||
| 1,65 | 1,48 | 2,08 | ||||||
| 0,88 | 1,00 | 0,56 | ||||||
| 2,04 | 2,47 | 0,94 | ||||||
| 1,32 | 1,72 | 0,27 | ||||||
| 1,87 | 2,48 | 0,29 | ||||||
| 6,26 | 8,56 | 0,34 | ||||||
| 126,85 | 175,93 | |||||||
| 145,71 | 194,43 | 19,8 | 115450,8 | 4549,2 |
ТИПОВАЯ ЗАДАЧА 4.2.
Газ концевых ступеней сепарации в количестве 143.82 т/сут сжимается до давления первой ступени сепарации 0.5 МПа и охлаждается в воздушном холодильнике до 10 оС, затем поступает в сепаратор для отделения конденсата от газообразной фазы.
Молярный состав газа концевых ступеней сепарации принять следующим (%): метан 47.3, этан 9.03, пропан 18.81, изобутан 11.11, бутан 8.0, изопентан 1.95, пентан 2.1, гексан 1.7.
Определить составы газа и конденсата после компримирования и охлаждения. Найти количество получающегося конденсата.
Решение:
Решение задачи сводится к решению уравнения фазовых равновесий (4.8) и затем уравнений (4.5), (4.6). Константы фазового равновесия определяют по номограммам или таблицам.
Решения уравнения (4.8) при последовательных приближениях молярных долей газообразной фазы смеси Nv = 0.5; 0.99; 0.9; 0.9; 0.92; 0.91; 0.917 равны соответственно значениям левой части этого уравнения: 0.7998; -0.5308; 0.0553; -0.1440; -0.01010; 0.0243; 0.00059.
Если значение левой части уравнения (4.8) по абсолютной величине меньше 0.003, то поиски решения заканчиваются, а молярная доля газообразной фазы, при которой получено такое отличие левой части от нуля, используется в дальнейших расчетах.
Всего в сепаратор поступает 143.82т/сут смеси углеводородов, молярная масса которых равна

где r — число углеводородов в смеси.
Из всего количества молей смеси углеводородов
m/Mсм = 143.82/34.1 * 10 3 = 4217.6 кмоль/сут
0.917 составляет газ и 0.083 – соответственно, конденсат.