Цель урока:
- закрепление имеющихся знаний
- усвоение новых знаний учащимися.
Основные понятия: закон сохранения массы, закон постоянства состава, периодический закон Д.И. Менделеева, периодическая система химических элементов Д.И. Менделеева.
Оборудование и материалы: учебник, грифельная доска и мел.
Тип урока: проверка знаний, закрепление знаний, усвоение новых знаний.
План урока
I. Организационный этап.
Организация класса. (1-2 мин.)
II. Актуализация опорных знаний.
Объявление темы и цели урока. (1 мин)
Учитель задает следующие вопросы учащимся (3-5 мин):
1) Что такое «химия»?
2) Что такое «молекула»?
3) Что такое «атом»?
4) Дайте определение понятию «относительная атомная масса».
5) Дайте определение понятию «относительная молекулярная масса».
6) Дайте определение понятию «молярная масса». Запишите формулу на доске (можно с конспектом)
III. Мотивация учебной деятельности.
IV. Усвоение новых знаний.
Сейчас мы рассмотрим основные понятия и законы химии.
Относительная атомная масса (Ar) – величина, равная отношению средней массы атома к 1/12 массы атома углерода(единица измерения – атомная единица массы – а.е.м.)
Например: Ar (Н) = 1 а.е.м., Ar (О) = 16 а.е.м.
Относительная молекулярная масса (Mr) – величина, равная отношению средней массы молекулы к 1/12 массы атома углерода.
Например: Mr (H2SO4) = 2 + 32 + 64 = 98 (а.е.м.)
Количество вещества (ν) – это количество вещества, в котором содержится столько структурных единиц (атомов, молекул), сколько атомов или молекул содержится в 12/1000 углерода. Измеряется в молях (1моль).
ν = 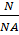 , NA = 6,02 * 10^23 – число Авогадро, N – число структурных единиц (атомов, молекул)
, NA = 6,02 * 10^23 – число Авогадро, N – число структурных единиц (атомов, молекул)
Молекулярная масса (M) – отношение массы вещества к его количеству.
|
|
M =  (г/моль).
(г/моль).
Решим вместе задачу (см. приложение).
Закон сохранения массы. Масса веществ, вступающих в реакцию, равна массе веществ, образующихся после реакции.
CO2 + O2 → CO2
Закон постоянства состава. Каждое чистое вещество, независимо от способа его получения, всегда имеет постоянно качественный и количественный состав.
CH4 + 2O2 → CO2 + 2H2O
Закон объемных отношений. Объемы вступающих в реакцию газов при одинаковой температуре и давлении относятся между собой, как простые целые числа.
2CO2 + O2 → 2CO2
Закон Авогадро. В равных объемах различных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул. То есть, 1 моль любого газа при нормальных условиях занимает одинаковый объем – молярный объем:
Vm = 22,4 (л/моль)
Н.у.: температура t = 0 C◦; T = 273 K◦;
Давление P = 101 кПа
Уравнение Менделеева-Клапейрона:
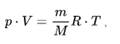
P – давление, кПа
V – объем (л)
m – масса (г)
м – молярная масса
R – универсальная газовая постоянная 8, 314 Дж/моль
T – температура (К)
Откройте страницу 10 учебника (§3) и законспектируйте понятие «периодический закон»
V. Обобщение и систематизация знаний.
1) Озвучьте основные понятия и их определения, которые мы рассмотрели на уроке.
2) Озвучьте основные законы, которые мы рассмотрели на уроке.
3) Озвучьте суть «нормальных условий»
4) Напишите на доске из конспекта уравнение Менделеева-Клапейрона.
VI. Домашнее задание
Готовить §2-3, конспект
(2-3 мин.)
Список литературы
А) Литература, использованная учителем:
Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. — 4-е изд., испр. — М.: Высш. шк., Изд. центр «Академия», 2001. — 743 с., ил.
|
|
Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы 4-е изд., испр. и доп. — М.: Новая Волна: Издатель Умеренков, 2002. — 278 с.
Б) Литература, рекомендованная учащимся:
Рудзитис Г.Е., Фельдман Ф.Г. – 2-е изд. - М.: Просвещение, 2016. - 208с., ил.
Приложение
Задача
Дана масса вещества (H2SO4) 4,9 г. Рассчитайте количество вещества.
Ход решения задачи:
Дано: Решение:
| m (H2SO4) = 4,9 г | M =  → → 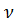 = = 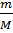 ν (H2SO4) =
ν (H2SO4) = 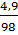 = 0,05 моль = 0,05 моль
|
| ν (H2SO4) -? |
Ответ: 0,05 моль