КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ.
Это соединения, содержащие в молекуле КАРБОНИЛЬНУЮ группу >C=O.
АЛЬДЕГИДАМИ называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. Общая формула альдегидов:

КЕТОНАМИ называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. Общая формула кетонов:

ВИДЫИЗОМЕРИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ.
Изомерия альдегидов:
v изомерия углеродного скелета, начиная с С4

v межклассовая изомерия с кетонами, начиная с С3

v непредельными спиртами и простыми эфирами (с С3)

Изомерия кетонов:
v углеродного скелета (c C5)

v положения карбонильной группы (c C5)

v межклассовая изомерия (с альдегидами).

ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ.
| 1.Окисление спиртов: а) при окислении первичных спиртов – образуются альдегиды б) при окислении вторичных спиртов – получаются кетоны. | Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
 Окислить первичный спирт до альдегида можно:
а) нагреванием над оксидом меди (II):
СН3-СН2-СН2-ОН+CuO tàCH3-CH2-C=O + Cu + H2O
\
H
б) пропусканием смеси паров спирта с кислородом над медной сеткой:
2СН3-СН2-СН2-ОН + O2 Cu,tà2CH3-CH2-C=O + 2H2O
\
H
При окислении вторичных спиртов образуются кетоны.
Окислить первичный спирт до альдегида можно:
а) нагреванием над оксидом меди (II):
СН3-СН2-СН2-ОН+CuO tàCH3-CH2-C=O + Cu + H2O
\
H
б) пропусканием смеси паров спирта с кислородом над медной сеткой:
2СН3-СН2-СН2-ОН + O2 Cu,tà2CH3-CH2-C=O + 2H2O
\
H
При окислении вторичных спиртов образуются кетоны.

|
| 2. Дегидрирование спиртов:нагревание над медной сеткой. | СН3-СН2-СН2-ОН Cu,tà CH3- CH2 - C=O + H2 \ H |
| 3. Реакция Кучерова – гидратация алкинов. а) при гидратации ацетилена получается ацетальдегид, б) при гидратации других алкинов – кетоны. | Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
 Кетоны получают при гидратации других гомологов ряда алкинов:
Кетоны получают при гидратации других гомологов ряда алкинов:

|
| 4. Гидролиз дигалогенпроизводных алканов.Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон. | СН3–CH2- CHCl2 + 2 KOH à[CH3-CH2-CH-OH]+2KCl à | à H2O + CH3- CH2 - C=O OH \ H |
| 5. Пиролиз кальциевых солей карбоновых кислот – получаются кетоны. | (СН3-СОО)2Са tà CaCO3 + CH3-C-CH3 ацетат кальция || О |
| 6.Окисление алкенов (катализаторы - хлориды Pd и Cu) | 
|
| 7.Кумольный способ получения ацетона (наряду с фенолом). | 
|
СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ.
| 1. Гидрирование | Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны - вторичные:

|
| 2. Присоединение циановодорода, гидросульфита натрия и спиртов. | 1.Присоединение циановодородной (синильной)кислоты HCN:
 2.Присоединение спиртов с образованием полуацеталей (в присутствии кислоты или основания как катализатора):
2.Присоединение спиртов с образованием полуацеталей (в присутствии кислоты или основания как катализатора):
 Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
 3.Присоединение гидросульфита натрия дает кристаллические вещества, обычно называемые гидросульфитными производными альдегидов.
OH
/ CH3–C=О + HSO3Na à CH3–С–SO3Na
\ \
H H
3.Присоединение гидросульфита натрия дает кристаллические вещества, обычно называемые гидросульфитными производными альдегидов.
OH
/ CH3–C=О + HSO3Na à CH3–С–SO3Na
\ \
H H
|
| 3. Окисление альдегидов. Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием мягких окислителей:оксид серебра (аммиачный раствор) и гидроксид меди (II). Данные реакции являются качественными на альдегидную группу. | Реакция "серебряного зеркала" – окисление аммиачным раствором оксида серебра: R–CH=O+2[Ag(NH3)2]OH àRCOONH4 +2Ag + 3NH3 + H2O соль аммония карбоновой кислоты В случае муравьиного альдегида – продуктом является карбонат аммония. НCH=O+4[Ag(NH3)2]OH à(NH4)2СО3+ 4Ag + 6NH3 + 2H2O При подкислении реакционной смеси выделяется карбоновая кислота, а в случае муравьиного альдегида – углекислый газ. Иногда пишут упрощенный вариант реакции: RCH=O + Ag2O (NH3)à RCOОH + 2Ag Окисление гидроксидом меди (II) при нагревании с образованием красно-кирпичного осадка Cu2O: RCH=O +2Cu(OH)2 tà RCOOH+Cu2O+2H2O красный осадок КЕТОНЫокисляются с трудом при действии сильных окислителей и нагревании с разрывом С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы. |
| 4. Конденсация с фенолами. | Практическое значение имеет реакция формальдегида с фенолом (катализаторы - кислоты или основания):
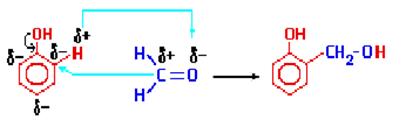 Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол.
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол.

|