Практическая работа.
Составление схем систематического хода анализа по обнаружению катионов в солях.
Задание: Внимательно прочитайте анализы смеси катионов, переписывать не нужно, необходимо перерисовать 6 схем систематического хода катионов всех групп.
Присылать работу не нужно, проверю все на уроке.
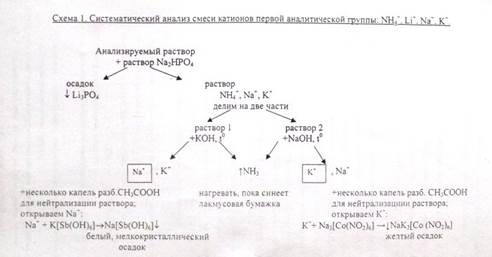
Анализ смеси катионов первой аналитической группы: Li+, Na+, К+, NН4+.
Катионы первой аналитической группы не имеют группового реагента. Катионы Li+ и NH4+мешают открытию катионов Na+ и К+, поэтому из анализируемого раствора их нужно удалять. Вначале в отдельных пробах анализируемого раствора открывают катионы Li+ и NН4+, после чего эти ноны удаляют, а в остатке открывают К+, Nа+.
I. Предварительные испытания (проводят в отдельной порции анализируемого раствора).
1. Открытие катионов Li+:
а) раствор + Na2НРО4 → белый Li3PO4 ↓ (рН=7-8);
б) раствор + NH4F → LiF ↓ (белый)
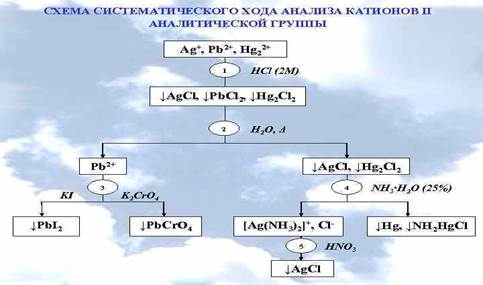
Анализ смеси катионов второй аналитической группы: Ag+,Hg2+,Pb2+.
Открыть ионы дробно в смеси невозможно, т.к. нет избирательного реагента, поэтому проводят систематический анализ.
К анализируемому раствору прибавляют на холоде групповой реагент-раствор (2 моль/л) HCI до полного выделения осадка, состоящего из AgCl, Hg2CI2, РbСl2 (если раствор остается прозрачным при добавлении 2 капель НCl, осаждение считается полным).
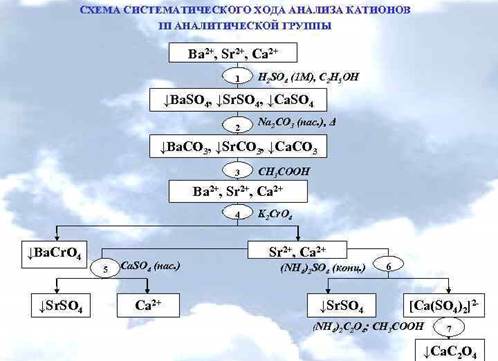
Анализ смеси катионов третьей аналитической группы: Сa2+, Sr2+, Ba2+.
Анализ раствора, содержащего смесь катионов третьей аналитической группы, обычно проводят по следующей схеме.
Вначале проводят предварительные испытания: в отдельных небольших пробах анализируемого раствора дробно открывают катионы, присутствующие в растворе, учитывая их взаимное влияние друг на друга. Часто этим ограничиваются. При необходимости проводят систематический анализ, как описано в схеме 3.
I. Предварительные испытания.
1. Открытие катионов бария (II):
Ва2+ + К2Сr2O7 (в прис. СН3СОО–) → ВаСrО4 ↓ – желтый, осадок не растворяется в разбавленной уксусной кислоте;
2. Sr2+ и Са2+ может открыть, только если нет Ва2+.
Sr3+ + CaSО4 → SrSO4↓ + Са2+ (реакция с гипсовой водой);
Са2+ + K4[Fe(CN)6] + 2 NH4+ → (NH4)2Ca[Fe(CN)6]↓ белый осадок (Sr2+ не мешает);
3. Если нет Ва2+ и Sr2+, то Са2+ + Na2C2O4 → СаС2O4 ↓ белый
Осадки гидроксидов не растворяются в полном аммиаке, за исключением Zn(OН)2, который образует аммиачный комплекс [Zn(NH3)4]2+. В присутствии H2О2 катионы Cr3+, As3+, Sn2+ окисляются соответственно до СrO42-, AsO43-, [Sn(ОH)6]2- ионов. Мышьяк (III) и мышьяк (V) считаются катионами As3+, As5+ условно, т.к. в полных растворах они присутствуют и виде ионов AsO33- и AsO43- соответственно.
Анализ смеси катионов четвертой аналитической группы:
Zn2+, Аl3+, Sn2+, Sn4+, As3+, Cr3+, As5+.
При анализе раствора, содержащего катионы четвертой аналитической группы, сначала целесообразно провести предварительные испытания, а затем систематический анализ.
I. Предварительные испытания.
1. Открытие Сr3+ (если они присутствуют, раствор должен быть сине-зеленым):
[Cr(H2О)6]3+ (зеленый)+ Н2О2(3%) + NaOH изб. → СrО42- (желтый)
2. Открытие Sn2+:
Sn2+ + NaOH + Bi(NO3)3 (1-2 капли) → Вi ↓ +[Sn(OH)6] 2-
3. Открытие As3+ (AsO33- в растворе):
AsO33- + AgNO3 → Ag3AsO3↓ желтый, аморфный
4. Открытие As5+ (AsO43- в растворе):
AsO43- + AgNO3 = Ag3AsO4 аморфный осадок шоколадного цвета

Анализ смеси катионов пятой аналитической группы:
Mg2+, Mn2+, Sb3+, Sb5+, Fe2+, Fe3+, Bi3+
Некоторые катионы данной аналитической группы удобнее открыть в предварительных испытаниях. Систематический анализ смеси катионов проводят по схеме 5.
1. Предварительные испытания.
1. Открытие ионов Fe2+:
4Fe2+ +3 K3[Fe(CN)6] → Fe4[Fe(CN)6]3 +9K+ – темно-синий осадок «турнбуленовой сипи»
2. Открытие ионов Fe 3+ (если ионы присутствуют в растворе, последний имеет желтоватую окраску):
а) 4Fe3+ + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 +12K+ – темно-синий осадок «берлинской лазури»
б)Fe3+ + 6SCN– → [Fe(SCN)6]3- – красное окрашивание раствора
3. Открытие ионов Мn2+:
а) Mn2+ + NaBiO3 +Н+ → МnO4– + Bi3+ + Na+
б) Мn2+ + РbO2 + H+ → МnО4– + Рb2+
МnO4– – ноны окрашивают раствор в малиновый цвет.
4. Открытие ионов Bi3+ (реакцию проводят о щелочной среде, рH=10):
Bi(OH)3 +[Sn(OH)4] 2- → Bi↓ + [Sn(OH)6] 2- черный

Анализ смеси катионов шестой аналитической группы: Сu 2+, Сd 2+, Hg 2+, Cо 2+, Ni 2+.
Перед проведением систематического анализа в отдельных пробах анализируемого раствора можно открыть некоторые катионы с помощью характерных для них реакций.
Некоторые выводы можно сделать по окраске анализируемого раствора: так, катионы Ni2+ придают раствору зеленоватую окраску, Со2+ – розовую, Сu2+ – голубую.
Отдельную порцию раствора можно обработать водным раствором аммиака и проанализировать окраску раствора, зная, что водные растворы аммиачных комплексов металлов окрашены следующим образом:
[Cu(NH3)4] 2+ – синий;
[Co(NH3)6] 2+ – сине-фиолетовый;
[Co(NH3)4] 2+ – желтый;
[Cd(NH3)4] 2+, [Hg(NH3)4] 2+ – бесцветные.
Систематический анализ проводят в соответствии со схемой 6.
