Раствор – это гомогенная система, в которой одно вещество равномерно распределено в среде другого (или других) веществ. Раствор – это однофазная гомогенная система, образующаяся не менее чем 2-мя компонентами. Состав раствора можно изменять непрерывно в определенных пределах.
Растворы делятся на:
-газообразные (воздух)
-жидкие (морская вода)
-твердые (Au-Ag)
В жидких растворах различают растворители и растворенные вещества. Растворителем называют жидкий компонент раствора, который имеется в избытке по сравнению с остальными компонентами раствора. Остальные компоненты раствора, которые находятся в растворе в меньшем количестве, называются растворенными веществами.
В 19 веке развивались 2 противоположных теории растворов: химическая теория, в которой все свойства растворов пытались объяснить образованием в них химических соединений (Д. И. Менделеев и др.) и физическая, в которой растворенное вещество рассматривалось как газ, который заполняет инертный растворитель (Якоб Хендрик Вант-Гофф, Сванте Аррениус и др.). В современной физико-химической теории растворов (основоположники Иван Алексеевич Каблуков, Владимир Александрович Кистяковский) признается важность как физических, так и химических сил между частицами (молекулами, атомами, ионами) в растворе.
Растворение ионных веществ в воде состоит из 2-х стадий. 1 стадия – разрушение кристаллической решетки под действием дипольных молекул воды. При этом энергия затрачивается (ΔH1 > 0, Q1 < 0). 2 стадия – образование около каждого иона слоя тесно связанных с ним молекул воды – гидратация (в общем случае – сольватация). Итак, сольватация – это взаимодействие между молекулами растворителя и растворенного вещества. Теплота выделяется (ΔH2 > 0, Q2 < 0).
Общая теплота растворения ΔsolH°инт = ΔH1 + ΔH2. Часто для солей ΔsolH°инт > 0 и эффект эндотермический (NaCl, NH4Cl). Для некоторых веществ ΔsolH°инт < 0 и эффект экзотермический (NaOH, KOH).
Если ионное соединение было сразу в молекулярном виде, то ΔH1 = 0, ΔsolH°инт = ΔH2 < 0 (H2SO4, HCl). Совокупность молекул растворителя, окружающих ион, представляют собой сольватную оболочку. Первичной сольватной оболочкой называют воздействие иона на ближайшие молекулы растворителя, которые при этом теряют независимое движение и перемещаются вместе с ионом. Воздействие иона на более удаленные молекулы растворителя, влияющее на структуру растворителя в целом и на макроскопические свойства раствора, называется вторичной сольватной оболочкой.
Основными характеристиками раствора являются его состав и химические потенциалы компонентов раствора.
Способы выражения состава растворов.
| Название | Формула | Единица измерения |
| Массовая доля | 
| % или доли единицы |
| Мольная доля | 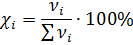
| % или доли единицы |
| Молярная концентрация (молярность) | 
| моль/л, М |
| Молярная концентрация эквивалента (нормальность) | 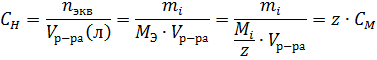
| моль/л, Н |
| Моляльность | 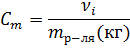
| моль/кгр-ля |
Основным вопросом термодинамической теории растворов является установление зависимости равновесных свойств от состава и свойств его исходных компонентов.
Виды растворов
Идеальные растворы – это растворы, в которых частицы взаимодействуют одинаково, независимо от их химической природы. Признаком идеальности раствора является аддитивность парциальных давлений, парциальных объемов, теплоемкостей и энтропий компонентов. Тепловой эффект при образовании идеального раствора ΔH = 0, объем не изменяется ΔVm = 0, а изменение энтропии равно идеальной энтропии смешения ΔS = ΔSсмеш. ид. = -χ1Rlnx1 – χ2Rlnx2.
Идеальные растворы подчиняются закону Рауля и следствиям из него. Идеальный раствор – это идеальная модель. Наиболее близки к ним растворы из молекул, очень похожих друг на друга («подобное растворяется в подобном»). Например, это смеси изотопов, смеси изомеров, смеси гомологов и т. д.
Предельно разбавленный раствор – это раствор, в котором концентрация растворенного вещества мала. Растворитель подчиняется законам идеального раствора, а растворенное вещество не подчиняется.
Неидеальные растворы (реальные) – все растворы, которые не относятся к идеальным или предельно разбавленным растворам. Вместо концентраций применительно к ним используются активности.
Среди неидеальных растворов выделяют:
1) Регулярные растворы – это реальные растворы, у которых при смешении компонентов, взятых в одинаковом агрегатном состоянии, изменение энтальпии и объема не равны нулю, ΔH ≠ 0, ΔVm ≠ 0, но изменение энтропии такое же, как у реальных растворов: ΔS = ΔSсмеш. ид. Это растворы неполярны неассоциированных жидкостей: C6H6 и C6H12, C6H12 и CCl4, C6H6 и CCl4.
2) Атермальные растворы – реальные растворы, теплота образования которых равна нулю ΔH = 0. Они близки к идеальным, но состоят из компонентов, существенно различающихся по размерам и, следовательно, разными Vm. Это растворы ВМС в низкомолекулярных соединениях.