Потенциометрический метод анализа.
Потенциометрический метод анализа основан на измерении величины электродного потенциала в зависимости от физических или физико-химических процессов. Потенциомéтрия – электрохимический метод анализа, основанный на определении количества вещества в анализируемом образце по величине электродного потенциала. Плюсами метода являются:
· Высокая точность, высокая чувствительность;
· Возможность проводить титрования в более разбавленных растворах, чем это позволяют визуальные индикаторные методы;
· Возможность потенциометрического определения нескольких веществ в одном растворе без предварительного разделения;
· Возможность титрования в мутных и окрашенных средах.
· Значительно расширяется область практического применения потенциометрического титрования при использовании неводных растворителей: они позволяют, например, найти содержание компонентов, которые в водном растворе раздельно не титруются, провести анализ веществ, нерастворимых или разлагающихся воде;
· Возможность автоматизации процесса титрования.
Недостатком метода является его достаточно высокая длительность, которая обусловлена двумя факторами:
· Временем, необходимым для установления потенциала системы после добавления титранта;
· Необходимостью делать при титровании большое число отсчетов. Различают прямую потенциометрию и потенциометрическое титрование
Диффузионный потенциал возникает в результате неравномерного распределения катионов и анионов вдоль границы раздела растворов двух разных электролитов или растворов разной концентрации одного электролита. Скорость диффузии ионов через поверхность раздела зависит от подвижности ионов и градиента концентрации. На величину диффузионного потенциала влияют заряд и подвижность ионов, концентрация вещества в растворе, природа растворителя и др. С целью устранения диффузионного потенциала применяют раствор электролита (солевой мостик). В качестве электролита используют насыщенные растворы KCI, KNO3, NH4NO3.
Растворимость металла зависит от его природы и температуры. Для данного металла при данной температуре она постоянна. У различных металлов вследствие неодинаковой энергии связи атомов в кристаллической решетке и различной способности их катионов к гидратации поверхностное растворение протекает в неодинаковой степени и, следовательно, равновесные электродные потенциалы, возникающие на границе «металл-раствор», будут различными. Кроме того, величина потенциала зависит от природы электрода, концентрации раствора, в который электрод опущен и от характера протекающих в растворе реакций. Электродные потенциалы измеряются в вольтах, В и вычисляются в соответствии с уравнением Нернста:
Где – стандартный (нормальный) электродный потенциал – электродный потенциал данного металла, погруженного в раствор, в котором активность металла равна 1 г-ион/л;
а – активность ионов металла в растворе, г-ион/л: а = СМ. α (α – степень диссоциации);
n – число перемещенных электронов, равно заряду иона металла;
R – универсальная газовая постоянная, 8,314 кДж/(моль.К);
F – постоянная Фарадея – количество электричества, необходимое для выделения на электроде 1 грамм-эквивалента вещества, F = 96 500 Кл;
Т – абсолютная температура, при стандартных условиях равна 298 К.
С учетом всех постоянных и множителя, переводящего натуральный логарифм в десятичный
Задача
Рассчитать потенциал серебряного электрода, опущенного в раствор нитрата серебра AgNO3 с активностью 0,429 моль/1000 г воды. Величина стандартного электродного потенциала серебряного электрода равна 0,799 В.
Электроды потенциометрии
Потенциометрический метод анализа основан на использовании зависимости электрического сигнала (потенциала) специального датчика, называемого измерительным электродом, от состава анализируемого раствора. В идеальном случае измерительный электрод избирательно (селективно) реагирует на определенный ион (или группу ионов), а его потенциал зависит от содержания этих ионов в растворе и подчиняется уравнению Нернста. На практике может наблюдаться некоторое несоблюдение этих положений, объясняющееся, например, мешающим влиянием некоторых ионов либо другими факторами. Форма и назначение как измерительных потенциометрических электродов, так и электродов сравнения весьма различна, но во всех случаях они подсоединяются к потенциометру, с табло которого и будут сниматься показания величины электродного потенциала Е (В) или рН анализируемой системы, в зависимости от выбранного режима работы потенциометра. Измерительные электроды подразделяют на две группы: · рН-электроды (то есть электроды, селективные к иону водорода); · электроды, селективные к прочим ионам, которые называют ионселективными электродами.
а) Стеклянные электроды
Со стеклянными электродами можно проводить измерения рН в присутствии окислителей, восстановителей, каталитических ядов, а также в присутствии ионов тяжёлых металлов, то есть могут применяться для большинства растворов и поэтому получили наиболее широкое применение. Применение стеклянных электродов невозможно в растворах, содержащих плавиковую кислоту (или ее соли) вследствие химического взаимодействия материала электрода с данными реагентами: SiO2 + 4HF → SiF4 + 2H2O
Б) Водородный электрод
Нормальный водородный электрод используется в качестве электрода сравнения и устроен следующим образом: платиновую пластинку, электролитически покрытую слоем платины, погружают в раствор серной кислоты, содержащий Н+ -ионы в количестве 1 г-ион на 1 л раствора. Через раствор пропускают струю чистого водорода под нормальным давлением. При этом водород в большом количестве поглощается платиной, вследствие чего поверхность пластинки покрывается пленкой из газообразного водорода. В растворе имеются ионы Н+. Равновесный электродный потенциал устанавливается на границе: газообразный водород на пластинке - ион водорода в растворе.
В) Каломельный электрод
Каломельный электрод используется в качестве электрода сравнения при измерении электродных потенциалов некоторых металлов в случае, когда невозможно использовать нормальный водородный электрод. Электроды в потенциометрическом анализе выступают в роли индикаторов.
г) Хлорсеребряный электрод сравнен ия
Хлорсеребряный электрод характеризуется стабильностью потенциала (при 25°С потенциал насыщенного хлорсеребряного электрода составляет 0,222 В) и простотой конструкции и, наряду с водородным и каломельным электродами, используется в потенциометрии в качестве электрода сравнения.
д) Ионселективные электроды для определения Cl-, Ca2+, NH4 +, NO3 –
Большинство ионселективных электродов не обладают высокой избирательностью (селективностью) и эффективны в довольно узком диапазоне концентраций (обычно 4 – 6 порядков), поэтому область применения ионометрии не особенно широка.
Абсолютную величину потенциала в настоящее время измерить невозможно, однако можно измерить потенциал относительно другого электрода, потенциал которого известен и не зависит от состава раствора. Такой электрод и называется электродом сравнения. Наиболее известные электроды сравнения – это водородный, каломельный и хлорсеребряный электроды. Таким образом, измерения всегда проводятся при помощи двух электродов:
измерительного и электрода сравнения (электродная пара). В последнее время получили широкое распространение электроды, объединяющие в одном корпусе измерительный электрод и электрод сравнения. Такие электроды получили название комбинированных электродов.
Е) комбинированные электроды
Индикаторный электрод, объединяющий в своем корпусе гальваническую пару, состоящую из измерительного электрода и электрода сравнения, называется комбинированным электродом.
Задача
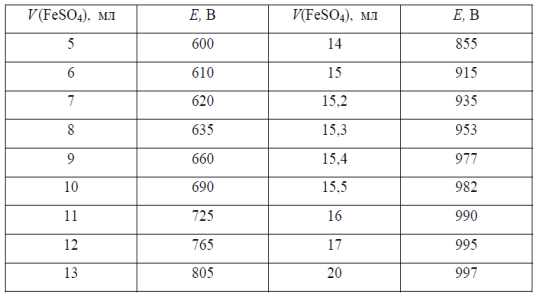
В навеске сплава массой 1,2500 определяли содержание хрома потенциометрическим титрованием. При растворении сплава хром окислили до хромовой кислоты H2CrO4. Титрование проводили раствором сульфата железа (II) с концентрацией Т(FeSO4/Cr) = 0,005020 г/мл. Вычислить массовую долю (масс. %) хрома в сплаве по следующим данным потенциометрического титрования.
таблица 1
Результаты потенциометрического титрования хрома (VI) рабочим раствором железа (II)