Комплексными соединениями называются такие соединения, в узлах кристаллических решеток которых находятся комплексные ионы, устойчивые как в твёрдом состоянии, так и в растворах.
Комплексными ионами называется сложные ионы, в состав которых входят катионы или атомы металлов, связанные с несколькими полярными молекулами или анионами.
Комплексные соединения имеют центральный атом (комплексообразователь), вокруг которого координируются лиганды (молекулы или анионы), причём количество лигандов больше, чем валентность центрального атома.
Комплексообразователем (центральным атомом) обычно является атом или катион переходного элемента, обладающий вакантными (незаселенными) атомными орбиталями.
Лигандами выступают частицы, у которых имеются неподелённые пары электронов: либо нейтральные полярные молекулы (NH3, H2O, NO и др.), либо анионы – кислотные остатки (F-, Cl-, Br-, I-, CN-, NO2-, SCN-), а также гидроксид-ион ОН-.
Число лигандов, непосредственно соединенных с комплексообразователем, называется координационным числом. Координационное число чаще всего равно 6, 4 или 2.
Рассмотрим типичный состав комплексных соединений на примере [Cu(NH3)4]SO4. Частица [Cu(NH3)4]2+ называется комплексным ионом (другие названия: внутренняя сфера, комплекс), а SO42- – внешней сферой. Катион Cu2+ в комплексе называется комплексообразователем, а молекулы NH3 – лигандами.
По заряду комплекса эти соединения подразделяются на катионные, например [Zn(H2O)4]Cl2, анионные – K3[Co(CN)6], двойные (катион-анионные) – [Ni(NH3)6]2[Fe(CN)6] и нейтральные – [Pt(NH3)2Cl4].
По виду лигандов комплексные соединения подразделяются так:
1) аквакомплексные, лигандами являются молекулы воды, например [Cr(H2O)6]Cl3;
2) амминокомплексные, лигандами являются молекулы NH3, например [Cd(NH3)6](NO3)2;
3) гидроксокомплексные, лигандами являются ОН--ионы, например Na3[Al(OH)6];
4) ацидокомплексные, лигандами являются кислотные остатки, например K4[FeCl6];
5) смешанные, лигандами являются различные частицы, например [Pt(NH3)2(H2O)2Br2]SO4.
При растворении комплексные соединения (кроме нейтральных) диссоциируют в растворе по типу сильного электролита, распадаясь на ионы внешней сферы и комплексные ионы, например:
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3-
Диссоциация комплексного соединения по внешней сфере называется первичной.
В свою очередь комплексные ионы способны далее частично диссоциировать по типу слабого электролита, ступенчато отщепляя лиганды внутренней сферы. Диссоциация комплексного иона называется вторичной. Вторичная диссоциация комплексных соединений протекает в очень незначительной степени, поскольку координационная связь во внутренней сфере комплекса намного прочнее, чем ионная связь внешней сферы.
Во многих случаях диссоциация комплексного иона может быть обнаружена с помощью соответствующего реактива, если последний обладает достаточной чувствительностью. Так, например, наличие ионов Ag+ в растворе комплексной соли [Ag(NH3)2]Cl обнаруживают с помощью иодида калия, добавление которого вызывает разрушение комплексного иона за счёт образования жёлтого осадка иодида серебра. Объясняется это следующим образом.
Произведение растворимости ПР (произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита) иодида серебра является весьма малой величиной:  . Поэтому, несмотря на ничтожно малую концентрацию ионов Ag+ в растворе [Ag(NH3)2]Cl, при добавлении KI произведение концентрации ионов [Ag+] и [I–] превышает величину произведения растворимости AgI, вследствие чего и выпадает осадок иодида серебра.
. Поэтому, несмотря на ничтожно малую концентрацию ионов Ag+ в растворе [Ag(NH3)2]Cl, при добавлении KI произведение концентрации ионов [Ag+] и [I–] превышает величину произведения растворимости AgI, вследствие чего и выпадает осадок иодида серебра.
Наоборот, другие реактивы на ион Ag+ (например, NaOH), которые образуют с ним соединения, обладающие бóльшей растворимостью, в данном случае не могут быть использованы для его обнаружения, так как не происходит разрушения комплексного иона.
Поскольку вторичная диссоциация – равновесный процесс, то для него можно записать выражение константы равновесия, которая называется константой нестойкости (Кнест.):
[Fe(CN)6]3- DFe3+ + 6CN-; Кнест. = 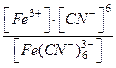 , где
, где
[Fe3+], [CN–] и [Fe(CN)63–] – равновесные концентрации ионов железа (III), цианид-ионов и гексацианоферрат (III)-ионов соответственно, моль/л.
Константа нестойкости – табличная величина. Зная её значение, можно оценить прочность комплексного иона. Чем меньше константа нестойкости, тем более устойчив комплекс.
Номенклатура комплексных соединений изучается в ходе самостоятельной работы. Напомним её правила.
В соединении сначала называют анион, а затем катион. При указании состава внутренней сферы прежде всего называют анионы, прибавляя к латинскому названию суффикс - о-,например: Cl– – хлоро, CN– – циано, OH– – гидроксо и т.д. Далее называют нейтральные лиганды, при этом пользуются терминами: для координированного аммиака – аммин, для воды – аква. Число лигандов указывают греческими словами: 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем переходят к названию центрального атома. Если центральный атом входит в состав катионов, то используют русское название соответствующего элемента и в скобках указывают его степень окисления (римскими цифрами).Если центральный атом содержится в анионе, тоупотребляют латинское название элемента, а в конце прибавляют окончание - ат. В случае неэлектролитов степень окисления центрального атома не приводят, т.к. она однозначно определяется из условия электронейтральности комплекса.
Название комплексного иона пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, помещенной в круглые скобки. Например:
[Zn(NH3)4](OH)2 – гидроксид тетраамминцинка, K3[Fe(CN)6] – гексацианоферрат (III) калия, [Ni(NH3)4][PtCl6] – гексахлороплатинат (IV) тетраамминникеля (II), [Cu(NH3)4]Cl2 – хлорид тетраамминмеди(II), [Co(NH3)3H2OCl2]NO3 – нитрат дихлороакватриамминкобальта(III), K3[Fe(CN)6] – гексацианоферрат(III)калия, K2[PtCl4] – тетрахлороплатинат(II)калия, [Zn(NH3)4Cl2] – дихлоротетраамминцинк, H2[SnCl6] – гексахлорооловянная кислота.
На примере нескольких комплексных соединений определим структуру молекул (ион-комплексообразователь, его степень окисления, координационное число, лиганды, внутреннюю и внешнюю сферы), дадим название комплексу, запишем уравнения электролитической диссоциации.
 K4[Fe(CN)6] – гексацианоферрат(II) калия,
K4[Fe(CN)6]
K4[Fe(CN)6] – гексацианоферрат(II) калия,
K4[Fe(CN)6]  4K+ + [Fe(CN)6]4–. 4K+ + [Fe(CN)6]4–.
|  Na[Al(OH)4] – тетрагидроксоалюминатнатрия,
Na[Al(OH)4]
Na[Al(OH)4] – тетрагидроксоалюминатнатрия,
Na[Al(OH)4]  Na+ + [Al(OH)4]–. Na+ + [Al(OH)4]–.
|
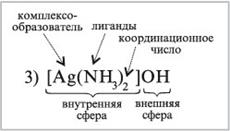 [Ag(NH3)2]OH – гидроксид диамминсеребра(I) (это вещество участвует в реакции «серебряного зеркала»),
[Ag(NH3)2]OH
[Ag(NH3)2]OH – гидроксид диамминсеребра(I) (это вещество участвует в реакции «серебряного зеркала»),
[Ag(NH3)2]OH  [Ag(NH3)2]+ + OH–. [Ag(NH3)2]+ + OH–.
|  H[AuCl4] – тетрахлорозолотая кислота (образуется при растворении золота в «царской водке»),
H[AuCl4]
H[AuCl4] – тетрахлорозолотая кислота (образуется при растворении золота в «царской водке»),
H[AuCl4]  H+ + [AuCl4]–. H+ + [AuCl4]–.
|
Экспериментальная часть
Целью работы является экспериментальное ознакомление со способами получения комплексных соединений, а также изучение их свойств.