ЗАКОНЫХИМИИ
1. ЗАКОН СОХРАНЕНИЯ МАССЫВЕЩЕСТВ (М.В. Ломоносов, 1748–1756 гг.; А. Лавуазье, 1777 г.).
Упрощенная формулировка: в изолированной системе масса продуктов реакции равна массе исходных веществ. С появлением теории относительности (А. Эйнштейн, 1905): полная энергия E пропорциональна массе m и связана с ней соотношением Е = mс2, где с – скорость света. Поэтому массу можно выражать в единицах энергии и сформулировать более общий закон сохранения массы и энергии: в изолированной системе сумма масс и энергии постоянна и возможны лишь превращения в строго эквивалентных соотношениях одних форм энергии в другие и эквивалентно связанные друг с другом изменения массы и энергии.
2. ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА (Ж. Пруст, 1799–1806 гг.)
Формулировка Пруста: каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав. Современная формулировка (с учетом существования 2х типов веществ – дальтонидов (веществ постоянного состава) и бертоллидов (веществ переменного состава)): каждое химически чистое вещество молекулярного строения или, точнее, вещество с ковалентной связью – дальтонид независимо от места нахождения и способа получения имеет один и тот же постоянный состав (закон постоянства свойств вещества).
3. ЗАКОН КРАТНЫХ ОТНОШЕНИЙ (Дж. Дальтон, 1803 г.)
Если два элемента могут образовывать между собой несколько соединений, то массовые доли любого из элементов в этих соединениях относятся друг к другу как небольшие целые числа.
ЗАКОН ЭКВИВАЛЕНТОВ
Элементы соединяются или взаимно замещают друг друга в количествах, равных или пропорциональных их эквивалентам. Эквиваленты элементов в химических соединениях могут быть переменными величинами; в этом случае значение эквивалента элемента зависит от характера превращения, претерпеваемого им при образовании химического соединения.
5. ЗАКОН АВОГАДРО (А. Авогадро, 1811 г.)
В равных объемах различных газов при одинаковой температуре и давлении содержится одно и то же число молекул.
1-е следствие из закона Авогадро: при одинаковых условиях равные количества различных газов занимают равные объемы. Отсюда следует: V1/V2 = n1/n2.
2-е следствие из закона Авогадро: при нормальных условиях (н.у.): Т = 273 K (0°С) и Р = 101,325 кПа (1 атм, 760 мм рт. ст.) – любой газ, количество которого равно 1 моль, занимает объем 22,4 л (молярный объем газа).
3-е следствие из закона Авогадро: относительная плотность одного газа (Х) по другому (А) равна отношению их молярных масс. D A (X) = r X /r A = M X /M A.
6. ЗАКОНЫДАЛЬТОНА (Дж. Дальтон, 1801 г.)
1. Давление смеси газов равно сумме их парциальных давлений Р = р 1 + р 2 + р 3 + …+ р n, где Р – общее давление газовой смеси, а р1, р2, р3, рn – парциальные давления составных частей. Из этого следует, что парциальное давление компонента газовой смеси равно произведению давления смеси на молярную долю этого компонента.
2. Растворимость компонента газовой смеси в данной жидкости при постоянной температуре пропорциональна парциальному давлению этого компонента и не зависит от давления смеси и природы других компонентов.
Оба закона Дальтона для газовых смесей строго справедливы лишь в том случае, если между компонентами смеси отсутствует какое-либо взаимодействие и каждый из компонентов, равно как и смесь, ведет себя как идеальный газ. Второй закон, кроме того, предполагает малую растворимость компонентов газовой смеси в жидкости.
7. ЗАКОН ОБЪЕМНЫХ ОТНОШЕНИЙ (Ж. Гей-Люссак, 1808 г.)
Объемы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных продуктов как небольшие целые числа.
| Газовые законы | Расчетные формулы | Газовые законы | Расчетные формулы | ||||
| Закон Бойля-Мариотта | 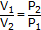 (при постоянных Т и n)
(при постоянных Т и n)
| Закон Гей-Люссака | 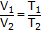 (при постоянных Р и n)
(при постоянных Р и n)
| ||||
| Закон Авогадро |  (при постоянных Р и Т)
(при постоянных Р и Т)
| Закон Шарля | 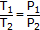 (при постоянных V и n)
(при постоянных V и n)
| ||||
Объединенный газовый закон 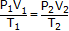
| |||||||
| Уравнение Менделеева-Клапейрона | рV =  RT RT
| R = 0,082 Р = атм V = л | R = 62360 Р = мм рт.ст. V = мл | R = 8,31 Р = Па V = м3 | |||
| Обозначения:V – объем; Р – давление; m – масса вещества; M – молярная масса вещества; R – универсальная газовая постоянная; n – количество вещества | |||||||
8. ПЕРИОДИЧЕСКИЙ ЗАКОН (ПЗ) (Д.И. Менделеев, 1869 г.)
ПЗ – фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д.И. Менделеевым в 1869 г. при сопоставлении свойств всех известных в то время элементов и величин их атомных весов.
Термин «периодический закон» Менделеев впервые употребил в ноябре 1870 г., а в октябре 1871 г. дал окончательную формулировку ПЗ: «...свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Графическим (табличным) выражением ПЗ явилась разработанная Менделеевым Периодическая Система (ПС) химических элементов.
Физический смысл ПЗ был открыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в ПС) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (Z) соответствующего элемента в ПС, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома. Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе ПЗ лежит представление об изменении заряда ядра атомов, а не атомной массы элементов. Наглядная иллюстрация ПЗ – кривые периодические изменения некоторых физических величин (ионизационных потенциалов, атомных радиусов, атомных объёмов) в зависимости от Z. Какого-либо общего математического выражения ПЗ не существует, его графическое выражение – ПС.
В настоящее время ПЗ имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Поиски основы естественной классификации и систематизации химических элементов начались задолго до открытия ПЗ:
Триады Дёберейнера (1829)
Спираль де Шанкуртуа (1862)
Октавы Ньюлендса (1866)
Таблицы Одлинга и Мейера (1864–1870)
На основании предположения, что атомная масса предопределяет свойства элемента, Д.И. Менделеев взял на себя смелость изменить принятые атомные веса некоторых элементов и подробно описать свойства не открытых ещё элементов. Для предсказания свойств простых веществ и соединений Д.И. Менделеев исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы (то есть сверху и снизу) и одновременно двух соседних элементов в периоде (слева и справа) (т.н. «правило звезды»).
Д.И. Менделеев на протяжении многих лет боролся за признание ПЗ; его идеи получили признание только после того, как были открыты предсказанные Д.И. Менделеевым элементы: галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886) – соответственно экаалюминий, экабор и экасилиций. С середины 1880-х годов ПЗ был окончательно признан в качестве одной из теоретических основ химии.
В отличие от своих предшественников, Д.И. Менделеев не только составил таблицу химических элементов и указал на наличие несомненных закономерностей в численных величинах атомных весов, но и решился назвать эти закономерности общим законом природы.
За весь срок существования ПС было опубликовано более чем 500 разных вариантов ее изображения. Это обусловлено попытками найти рациональное решение некоторых противоречивых вопросов структуры ПС (размещения Н, благородных газов, лантанидов и трансурановых элементов, и т.п.).
ПЗ имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов. Благодаря ПЗ многие научные поиски (например, в области изучения строения вещества – в химии, физике, геохимии, космохимии, астрофизике) получили целенаправленный характер.
ПЗ универсален для Вселенной: как образно заметил известный русский химик Н.Д. Зелинский, Периодический Закон явился «открытием взаимной связи всех атомов в мироздании».