Внимание! При выставлении баллов за выполнение задания в «Протокол проверки ответов на задания бланка № 2» следует иметь в виду, что если ответ отсутствует (нет никаких записей, свидетельствующих о том, что экзаменуемый приступал к выполнению задания), то в протокол проставляется «Х», а не «0».
| C1 |
Используя метод электронного баланса, составьте уравнение реакции:
K2Cr2O7 + … + H2SO4 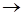 I2 + Cr2(SO4)3 + … + H2O
I2 + Cr2(SO4)3 + … + H2O
Определите окислитель и восстановитель.
Ответ:
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы | ||
Элементы ответа:
1) Составлен электронный баланс:
| |||
| 2) Расставлены коэффициенты в уравнении реакции: K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O | |||
| 3) Указано, что иод в степени окисления – 1 является восстановителем, а хром в степени окисления + 6 (или дихромат натрия за счет хрома в степени окисления + 6) – окислителем. | |||
| Ответ правильный и полный, включает все названные выше элементы | |||
| В ответе допущена ошибка только в одном из элементов | |||
| В ответе допущены ошибки в двух элементах | |||
| Все элементы ответа записаны неверно | |||
| Максимальный балл | 3 |
| C2 |
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
Ответ:
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: Написаны четыре уравнения возможных реакций с участием указанных веществ: 1) S + 6HNO3 (конц.) = H2SO4 + 6NO2 + 2H2O 2) S + 2H2SO4 (конц.) = 3SO2 + 2H2O 3) H2S + 2HNO3 (конц.) = S + 2NO2 + 2H2O 4) H2S + 3H2SO4 (конц.) = 4SO2 + 4H2O | |
| Правильно записаны 4 уравнения возможных реакций | |
| Правильно записаны 3 уравнения реакций | |
| Правильно записаны 2 уравнения реакций | |
| Правильно записано 1 уравнение реакции | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
| Примечание. Дополнительно записанные (правильно или ошибочно) уравнения реакций не оцениваются. |
| C3 |
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
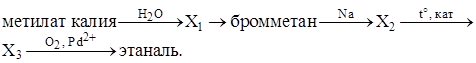
Ответ:
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа:
Написаны уравнения реакций, соответствующие схеме превращений:
1) CH3OK+ H2O 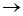 KOH + CH3OH
2) CH3OH + HBr KOH + CH3OH
2) CH3OH + HBr 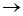 CH3Br + H2O
3) 2CH3Br + 2Na CH3Br + H2O
3) 2CH3Br + 2Na  С2H6 + 2NaBr
4) С2H6 С2H6 + 2NaBr
4) С2H6 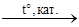 C2H4 + H2
5) 2C2H4 + O2 C2H4 + H2
5) 2C2H4 + O2 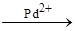 2CH3CHO 2CH3CHO
| |
| Ответ правильный и полный, включает все названные выше элементы | |
| Правильно записаны 4 уравнения реакций | |
| Правильно записаны 3 уравнения реакций | |
| Правильно записаны 2 уравнения реакций | |
| Правильно записано одно уравнение реакции | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 5 |
| C4 |
Для получения раствора сульфата калия рассчитанное количество карбоната калия растворили в 5%-ной серной кислоте. Определите массовую долю сульфата калия в полученном растворе.
Ответ:
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа:
1) Составлено уравнение химической реакции между серной кислотой и карбонатом калия:
К2CO3 + H2SO4 = К2SO4 + H2O + CO2↑
2) Рассчитаны количества веществ, вступивших в реакцию и полученных в ходе реакции:
В каждых 100 г раствора серной кислоты содержится 5 г её или n(H2SO4) = 5/98 = 0,051 моль
n(K2CO3) = n(H2SO4) = 0,051 моль,
n(CO2) = n(H2SO4) = 0,051 моль,
n(K2SO4) = n(H2SO4) = 0,051 моль,
3) Рассчитаны массы веществ:
m(K2CO3) = nM = 0,051∙138 = 7,04 г
m(K2SO4) = nM = 0,051∙174= 8,87 г
m(CO2) = nM = 0,051∙44 = 2,24 г
4) Найдена масса раствора и определена массовая доля сульфата калия в нем:
m(раствора) = 100 + 7,04 – 2,24 = 104,8 г
w(K2SO4) = 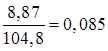 = 8,5% = 8,5%
| |
| Ответ правильный и полный, включает все названные выше элементы | |
| В ответе допущена ошибка в одном из названных выше элементов | |
| В ответе допущена ошибка в двух из названных выше элементов | |
| В ответе допущена ошибка в трех из названных выше элементов | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 4 |
| C5 |
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного, или 101 г дибромпроизводного.
Ответ:
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Элементы ответа: 1) Записаны уравнения реакций: CnH2n + Cl2 → CnH2nCl2 CnH2n + Br2 → CnH2nBr2 2) Указано, что n(CnH2n) одно и то же в двух реакциях (или что количества веществ галогеналканов равны друг другу): n(CnH2nCl2) = n(CnH2nBr2) 3) Найдена молекулярная формула алкена: 56,5/(14n+71) = 101/(14n+160) n = 3 Молекулярная формула С3Н6 | |
| Ответ правильный и полный, включает все названные выше элементы | |
| Правильно записаны два первых элемента из названных выше | |
| Правильно записан один из названных выше элементов (1-й или 2-й) | |
| Все элементы ответа записаны неверно | |
| Максимальный балл | 3 |