Окисление олефинов в альдегиды и кетоны
Образование карбонильных соединений из олефинов основано на известной реакции хлорида палладия с олефинами, при которой хлористый палладий восстанавливается до металла:
Образование ацетальдегида при взаимодействии этилена с водным раствором хлорида палладия наблюдал Филлипс еще в 1894 г. При взаимодействии палладиевого комплекса с водой происходит окисление активированного олефина с образованием ацетальдегида, выделением палладия и хлорида водорода. Шмидт (ФРГ) и Сыркин с Моисеевым (СССР) в результате исследования этой реакции предложили непрерывный процесс получения ацетальдегида, где восстановление металлического палладия совмещается с непрерывным его окислением кислородом воздуха.
В этом случае одновременно протекают две реакции, которые осуществляются раздельно или совмещаются в одном реакторе— окисление (карбонилирование) олефина (через стадию образования активного комплекса) и окисление металлического палладия.
Скорость второй реакции значительно ниже, чем первой, поэтому активность катализатора быстро падает.
Для повышения скорости окисления палладия применяются со-катализаторы—соли меди в солянокислой среде, играющие роль переносчиков кислорода
|
При избытке СuС12 реакция (3) протекает количественно. Конечной реакцией является окисление одновалентной меди в двухвалентную
Совмещение реакции (1) с реакциями (3) и (4) создало предпосылки для осуществления в промышленном масштабе получения ацетальдегида прямым окислением этилена молекулярным кислородом.
Процесс образования ацетальдегида в присутствии хлорида палладия из этилена в водной среде включает промежуточные стадии замещения хлорид-анионов в палладиевом координационном комплексе молекулами олефина и воды с образованием ¶-комплексов:
Окисление протекает по наименее гидрированному атому углерода у двойной связи, вследствие чего ацетальдегид образуется только из этилена, а из других олефинов—кетоны.
В результате частичной атаки по другому ненасыщенному атому углерода из ά-олефинов в качестве побочных продуктов получается небольшое количество альдегидов, например из пропилена — пропионовый альдегид.
Этим же путем можно из гомологов этилена вырабатывать кетоны (ацетон, метилэтилкетон), но их синтез не нашел большого применения из-за наличия других экономичных способов получения (например, получение ацетона при кумольном способе производства фенола) и пониженного выхода кетонов (85—90%) с одновременным образованием малоценных хлор-кетонов.
|
Таким образом, описываемый синтез нашел практическое применение главным образом для производства ацетальдегида.
Ацетальдегид в промышленности также получают другими методами:
- прямой гидратацией ацетилена:
- гидратацией этилена в этанол и дегидрированием последнего в ацетальдегид:
CH2 = CH2 + H2O → CH3 – CH2OH → CH3 – CHO + H2
Синтез ацетальдегида окислением этилена на катализаторе PdCl2 . CuCl2 дает выход альдегида свыше 95 %, не достигаемый при других способах, основан на более дешевом, чем ацетилен, сырье и протекает в одну стадию:
Ниже сопоставлены экономические показатели производства ацетальдегида тремя основными методами:
Таким образом, метод получения ацетальдегида прямым окислением этилена имеет явные экономические преимущества перед другими методами и вытесняет их из промышленности.
Реакция окисления этилена в ацетальдегид сопровождается выделением значительного количества тепла.
|
|
Процесс получения ацетальдегида окислением этилена может осуществляться на твердом катализаторе (гетерогенно-каталитический процесс) и с использованием жидкого катализаторного раствора (гомогенно-каталитический процесс). Твердый катализатор может быть использован в виде стационарной фазы или в псевдоожиженном слое. Носителями для катализатора могут служить силикагель, пемза, уголь и др. Гетерогеннокаталитический процесс сопряжен с трудностями, связанными с отводом значительного количества тепла реакции. Применение жидкого катализатора позволяет проще решать проблему отвода тепла — путем испарения части воды, содержащейся в катализаторном растворе.
В качестве побочных продуктов при окислении этилена в ацетальдегид образуются уксусная и муравьиная кислоты, хлорсодержащие продукты (метилхлорид, этилхлорид, ацетальдегидхлорид), продукты конденсации (кротоновый альдегид и др.) и диоксид углерода. На скорость реакции, селективность процесса и выход ацетальдегида существенное влияние оказывают: состав катализатора (содержание хлорида палладия и двухвалентной меди), кислотность среды, давление, температура, соотношение этилена и окисляющего агента.
Соотношение между общим количеством металлов окислительно-восстановительной системы (медью и палладием) должно быть от 25:1 до 50:1. Ведение процесса с катализатором такого состава экономично, так как палладий—дорогостоящий металл. Конверсия олефина зависит также от мольного соотношения в катализаторе меди и галогена (оптимальным является соотношение от 1:1,4 до 1:1,8). Поэтому добавляемый в ходе процесса галоген (в виде хлорводорода или этилхлорида) должен дозироваться с достаточной точностью. Если содержание хлора в катализаторе мало (соотношение медь: хлор меньше 1:1), снижается конверсия этилена. Если же количество галогена больше, чем при
|
соотношении медь: галоген ==1:2, реакция замедляется. В этом случае в катализатор добавляют ацетат меди.
Окисление этилена в ацетальдегид проводится в кислой (рН 0,8—3) или нейтральной среде (рН 6—7,5). Повышение рН приводит к выпадению из катализаторного раствора хлорида одновалентной меди, забивающей отверстия газораспределительного устройства, снижается выход альдегида.
Растворимость в воде солей, составляющих катализатор, ограничена, и на практике приходится работать с сильно разбавленными растворами катализатора, удельная производительность которых невелика. Более выгодно использовать суспензии катализатора в воде или в водных растворах уксусной кислоты (так называемый шламовый катализатор). Это дает возможность сочетать высокую концентрацию катализатора (до 90 % от общего объема реакционной массы) с хорошим отводом тепла.
В качестве сырья для получения ацетальдегида можно использовать не только концентрированный этилен, но и этан-этиленовую фракцию. Присутствие других непредельных углеводородов нежелательно, так как они образуют различные побочные продукты. Допускается содержание ацетилена не более 0,005%, высших олефинов не более 0,03% и серы 0,001 % (масс.). Диеновые углеводороды должны быть удалены селективным гидрированием.
Превращение этилена в ацетальдегид интенсивно протекает при 100—130°С, для поддержания реакционной массы в жидком состоянии требуется повышенное давление 0,3—1,11 МПа, мольное соотношение олефин: кислород должно составлять 2:1. Во избежание побочных реакций конденсации и хлорирования предусматривается непрерывный отвод ацетальдегида из зоны реакции по мере образования. Выход ацетальдегида в зависимости от условий реакции и состава катализатора колеблется в пределах 84—98 % (масс.).
| Технологическое оформление процесса
Существуют два варианта технологического оформления гомогенно-каталитического процесса—одностадийный (образование альдегида и окисление катализатора в одном аппарате) и двухстадийный (образование альдегида в одном аппарате, окисление металлического палладия — в другом).
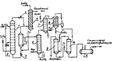
Реакционными аппаратами являются барботажные колонны; их для интенсификации массопереноса от газа к жидкости иногда заполняют насадкой. Из-за сильнокорродирующих свойств среды выполняют реакторы из титана или других кислотостойких материалов. Они не имеют теплообменных устройств, и реакционное тепло отводится за счет подогрева холодных реагентов и испарения. В двухстадийном варианте окисление этилена катализаторным раствором и регенерацию последнего воздухом проводят в двух разных аппаратах (рис. 30). В реактор 1 с кислотоупорной насадкой подают этилен и регенерированный катализаторный раствор, причем реакцию ведут до почти полной конверсии этилена при 0,8—0,9 МПа и 100—115°С. Полученный раствор ацетальдегида в восстановленном катализаторном растворе дросселируют и направляют в отпарную колонну 3, где отгоняют ацетальдегид и растворенные газы, поступающие на дальнейшее разделение. Катализаторный раствор с низа отпарной колонны подают насосом при 1 МПа в регенератор 2; туда вводят воздух, окисляющий ион металла до высшего валентного состояния. Регенерированный раствор возвращают в реактор 1. Достоинства этого варианта — его безопасность (ввиду разделения стадий, на которых присутствуют этилен и воздух) и использование воздуха в качестве окислителя.
|
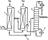 Рис. 30. Схема двухстадийного синтеза ацетальдегида при окислении этилена воздухом:
1 - реактор; 2 — регенератор; 3 — отпарная колонна; 4—насос; 5— дроссельный вентиль; 6 — дефлегматор; 7 —кипятильник
Рис. 30. Схема двухстадийного синтеза ацетальдегида при окислении этилена воздухом:
1 - реактор; 2 — регенератор; 3 — отпарная колонна; 4—насос; 5— дроссельный вентиль; 6 — дефлегматор; 7 —кипятильник
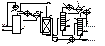 Рис. 31. Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом:
1—реактор; 2 — циркуляционный компрессор; 3 — холодильник; 4 — абсорбер; 5 — отпарная колонна: 6 — ректификационная колонна; 7—холодильник; 8—сепараторы; 9 — дефлегматоры
В одностадийном методе окисление этилена и регенерация катализатора совмещены в одном аппарате. Чтобы избежать образования
Рис. 31. Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом:
1—реактор; 2 — циркуляционный компрессор; 3 — холодильник; 4 — абсорбер; 5 — отпарная колонна: 6 — ректификационная колонна; 7—холодильник; 8—сепараторы; 9 — дефлегматоры
В одностадийном методе окисление этилена и регенерация катализатора совмещены в одном аппарате. Чтобы избежать образования
|
взрывоопасных смесей, ведут процесс в избытке этилена, возвращаемого затем на реакцию. Это делает необходимым применять в качестве окислителя не воздух, а технический кислород, конверсия которого в реакторе должна быть почти полной.
Схема одностадийного процесса изображена на рис. 31. В реактор 1 типа пустотелой барботажной колонны, заполненной катализаторным раствором, подают кислород и этилен (свежий и рециркулирующий). Реактор работает с постоянным уровнем жидкости при 130°С и 0,3 МПа. Избыточный этилен выдувает из раствора образовавшийся ацетальдегид, чем предотвращаются побочные реакции его конденсации. Вместе с ацетальдегидом испаряется часть воды, которую конденсируют в холодильнике 3 и возвращают в реактор.
Газопаровую смесь направляют в абсорбер 4, где ацетальдегид поглощают водой, орошающей насадку абсорбера. Основное количество остаточного газа, содержащего этилен, немного кислорода и инертные примеси, возвращают на окисление, дожимая его циркуляционным компрессором 2. Меньшую часть газа выводят с установки во избежание чрезмерного накопления в нем инертных примесей. Водный раствор ацетальдегида из куба абсорбера 4 поступает в отпарную колонну 5, где отгоняют растворенные газы и летучие примеси. Затем в колонне 6 в виде дистиллята получают ацетальдегид, а большую часть кубовой жидкости, содержащей менее летучие побочные продукты (кротоновый альдегид и др.), возвращают после охлаждения на абсорбцию.
Показатели обоих методов близки, и оба метода реализованы в промышленности. Одностадийный процесс по сравнению с двухстадийным дает экономию в капиталовложениях и расходе энергии, но связан с применением более дорогого окислителя – кислорода.
|
| Окисление олефинов по насыщенному атому углерода
Этим методом получают акролеин и акриловую кислоту:
Акролеин СН2=СНСНО (т. кип. 52,5°С) — жидкость с резким раздражающим запахом. Он хорошо растворим в воде и образует с ней азеотропную смесь. При длительном хранении или нагревании легко полимеризуется в циклические или линейные полимеры, что заставляет при его переработке использовать добавки ингибиторов. Акролеин представляет большой интерес как исходный продукт для получения полимеров и сополимеров с активной функциональной (карбонильной) группой. Кроме того, на его основе могут быть получены другие акриловые мономеры.
Акролеин широко применяется для получения акриловой кислоты и ее эфиров, аллилового спирта, синтетического глицерина и его производных, акрилонитрила. Значительное количество акролеина расходуется на производство метионина СН3SСН2СН2СН(NН2)СООН, аминокислоты, добавка которой в корм домашней птицы ускоряет ее рост. Акролеин используется также для получения гексантриола-1,2,6 и глутарового альдегида. Потенциальными областями применения акролеина и его производных являются производство полиуретанов, полиэфиров, различных пластификаторов и химикатов для текстильной промышленности.
Акриловая кислота и ее эфиры используются для получения полимеров с ценными свойствами, например, полиметилметакрилата (органического стекла или плексигласа), который широко используется для изготовления изделий бытового и технического назначения. Их получали из ацетальдегида и НСN, а затем из акрилонитрила, но из-за применения дорогостоящего сырья, серной кислоты и образования сульфата аммония эти способы заменяются методом прямого окисления пропилена.
| Производство акролеина
Акролеин может быть получен пиролизом диаллилового эфира:
конденсацией формальдегида с ацетальдегидом
и неполным окислением пропилена:
Метод получения акролеина пиролизом диаллилового эфира (побочного продукта при получении аллилового спирта из аллилхлорида) не получил распространения, так как оказалось, что выгоднее, наоборот, получать аллиловый спирт из акролеина.
Промышленное производство акролеина, основанное на альдольной конденсации формальдегида с ацетальдегидом, было осуществлено в США в 1955 г. Процесс вели в паровой фазе при 280—330°С над крупнопористым силикагелем, содержащем 10% силиката натрия (силикат натрия тормозит смолообразование). В качестве катализатора рекомендованы также силикат магния, фосфаты кальция, алюминия и др. Побочными продуктами являются кротоновый альдегид, метилформиат, метанол, муравьиная кислота и небольшие количества газа, состоящего из СО, СО2 и олефинов. Продукты реакции разделяют методом ректификации. Акролеин выделяют в виде азеотропной смеси с водой (2,7—3,0 %), после добавления 0,1 % гидрохинона или другого ингибитора она выдерживает хранение в течение нескольких лет.
|
Основным промышленным методом получения акролеина является газофазное каталитическое окисление пропилена. Этот метод наиболее экономичен и в настоящее время полностью вытеснил метод получения акролеина из формальдегида и ацетальдегида. Сырьем для каталитического окисления пропилена в акролеин может служить пропилен или пропан-пропиленовая фракция. Углеводородное сырье не должно содержать сернистых соединений и изопропилового спирта, так как они являются ядами для применяемых катализаторов. Нежелательно также присутствие в сырье 2-метилпропена и других высших олефинов, которые при температуре ниже требуемой для окисления пропилена превращаются в высшие гомологи акролеина. Наличие в сырье предельных углеводородов допускается. В качестве окислителя применяют воздух или кислород. Воздух дешевле технического кислорода, но разбавляет реакционные газы и затрудняет выделение и рециркуляцию веществ.
Состав исходной смеси ограничивается пределами взрывоопасных концентраций, поэтому в поступающую в реактор смесь всегда добавляют водяной пар [(25—50% (об.)], который способствует также повышению селективности за счет десорбции акролеина. Соотношение пропилена и кислорода (воздуха) в исходной смеси может быть различным: имеются установки, работающие с избытком пропилена [42—44 % (об.) С3Н6, 8—10% (об.) О2, 46—50% (об.) Н2O] и наоборот, с избытком кислорода или воздуха [7—8 % (об.) С3Н6, 67 % (об.) воздуха, 25% (об.) Н2О]. Очевидно, что в первом случае необходима рециркуляция непревращенного пропилена, чем и объясняется применение не воздуха, а кислорода. Степень конверсии по реагенту, находящемуся в недостатке, меняется от 60 до 100 %, а селективность от 70 до 90 %.
Процесс сопровождается образованием побочных веществ: ацетальдегида, ацетона, уксусной и акриловой кислот, СО и СО2. Оксиды
|
углерода, как обычно при гетерогенно-каталитическом окислении, получаются не только из акролеина, но и параллельно—непосредственно из пропилена.
Основными продуктами каталитического окисления пропилена в газовой фазе являются акролеин, диоксид углерода и вода:
Кроме того, образуются значительные количества формальдегида, ацетальдегида, оксида углерода, органических кислот, различных карбонильных соединений и относительно небольшие количества полимеров, которые могут дезактивировать катализатор.
Для селективного осуществления процесса важно иметь катализаторы, направляющие окисление в сторону преимущественного образования акролеина.
В качестве катализаторов окисления пропилена в акролеин были исследованы различные типы композиций: оксиды одно- и двухвалентной меди; смеси различных металлов переменной валентности или их оксиды; молибдаты, хроматы, сульфаты, фосфомолибдаты, ванадаты, алюминаты, силикаты меди, висмута, кобальта и др.
В качестве носителей предлагались карбид кремния, керамика, пемза, оксид алюминия и др.; в качестве промоторов—иод и селен.
Первыми из них были оксид меди(1) на носителях (0,1—1,5% Сu2O на пемзе, карборунде или А12O3) или даже медные трубки реактора. Позже были разработаны контакты из молибдата висмута (Вi2О3-МоО3) и фосформолибдата висмута (Bi2О3-МоО3P2О5), содержащие промоторы (оксиды теллура и меди). На этих катализаторах достигается достаточно высокая селективность при малом времени контакта и умеренной
|
температуре. Так, на оксиде меди(1) рекомендуется время контакта 0,2 с при 370—400 °С или 2 с при 320—350 °С. На молибдатах применяют более высокую температуру (400—500 °С) при времени контакта 1—2 с. Эти параметры в некоторой степени зависят от применяемого давления, которое на разных установках меняется от 0,1 до 1 МПа.
В настоящее время наиболее распространенным катализатором являются молибдаты висмута типа Вi2Мо2O9, Вi2Мо3O12, их композиции с оксидами других металлов, например Вi3FеМо2O12, и многокомпонентные катализаторы, включающие оксиды Fе, W, Те, Si, Р, Ni, Со, Sе и др. Многокомпонентные катализаторы характеризуются повышенной селективностью при малой длительности контакта и умеренной температуре.
Реакцию проводят в разных реакторах, но наибольшее применение нашли кожухотрубные аппараты со стационарным слоем катализатора, охлаждаемые расплавом солей. Расплав циркулирует через котел-утилизатор, генерируя пар высокого давления. Реакционные газы проходят затем абсорбер, где продукты окисления поглощаются водой и получается 1,5—2%-й раствор акролеина, содержащий ацетальдегид, ацетон и небольшое количество пропионового альдегида. Ацетальдегид легко отделяется ректификацией, а для очистки акролеина от близкокипящего пропионового альдегида (т. кип. 49°С) используют экстрактивную дистилляцию с водой. Полученный акролеин после разделения содержит 99 % основного вещества с примесью воды и пропионового альдегида.
Производство акриловой кислоты.
Для окисления акролеина в акриловую кислоту также используют оксидные висмутмолибденовые катализаторы с различными промоторами (Те, Со, Р и др.), но условия реакции более мягкие: температура 200 —300°С при времени контакта 0,5—2 с. Побочно образуются уксусная кислота и оксиды углерода при селективности процесса свыше 90 %.
|
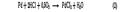
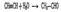
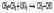
 Рис. 30. Схема двухстадийного синтеза ацетальдегида при окислении этилена воздухом:
1 - реактор; 2 — регенератор; 3 — отпарная колонна; 4—насос; 5— дроссельный вентиль; 6 — дефлегматор; 7 —кипятильник
Рис. 30. Схема двухстадийного синтеза ацетальдегида при окислении этилена воздухом:
1 - реактор; 2 — регенератор; 3 — отпарная колонна; 4—насос; 5— дроссельный вентиль; 6 — дефлегматор; 7 —кипятильник
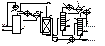 Рис. 31. Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом:
1—реактор; 2 — циркуляционный компрессор; 3 — холодильник; 4 — абсорбер; 5 — отпарная колонна: 6 — ректификационная колонна; 7—холодильник; 8—сепараторы; 9 — дефлегматоры
В одностадийном методе окисление этилена и регенерация катализатора совмещены в одном аппарате. Чтобы избежать образования
Рис. 31. Технологическая схема одностадийного синтеза ацетальдегида при окислении этилена кислородом:
1—реактор; 2 — циркуляционный компрессор; 3 — холодильник; 4 — абсорбер; 5 — отпарная колонна: 6 — ректификационная колонна; 7—холодильник; 8—сепараторы; 9 — дефлегматоры
В одностадийном методе окисление этилена и регенерация катализатора совмещены в одном аппарате. Чтобы избежать образования
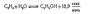 Так как реакция протекает с уменьшением объема и выделением тепла, то, как следует из термодинамики процесса, факторами,
Так как реакция протекает с уменьшением объема и выделением тепла, то, как следует из термодинамики процесса, факторами,
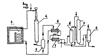 Рис. 32. Принципиальная технологическая схема производства этилового спирта прямой гидратацией этилена:
1,2 — теплообменники; 3 — печь; 4 — гидрататор; 5 — солеотделитель; 6,8 — сепараторы высокого и низкого давления, 7 — скруббер
Смесь нагревается до 200 °С за счет тепла нейтрализации продуктов. Далее паро-газовая смесь нагревается в печи 3 до 280—290 °С и поступает
Рис. 32. Принципиальная технологическая схема производства этилового спирта прямой гидратацией этилена:
1,2 — теплообменники; 3 — печь; 4 — гидрататор; 5 — солеотделитель; 6,8 — сепараторы высокого и низкого давления, 7 — скруббер
Смесь нагревается до 200 °С за счет тепла нейтрализации продуктов. Далее паро-газовая смесь нагревается в печи 3 до 280—290 °С и поступает
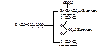 Диалкилсульфат может реагировать с серной кислотой с образованием алкилсульфата:
Диалкилсульфат может реагировать с серной кислотой с образованием алкилсульфата:
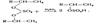
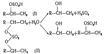 Кроме того, (II) может реагировать с образовавшимся в зоне реакции спиртом с выходом простого эфира (III) и алкилсульфата (I):
Кроме того, (II) может реагировать с образовавшимся в зоне реакции спиртом с выходом простого эфира (III) и алкилсульфата (I):
 Образование простого эфира (III) возможно также путем взаимодействия (II) с водой:
Гидролиз проводят при давлении 0,4—0,5 МПа и температуре 92—95° С. Для уменьшения выхода эфира (III) гидролиз ведут по возможности быстро и образовавшийся спирт быстро отгоняют от смеси, чтобы его концентрация в растворе была небольшой. Можно поступать и иначе. Реакционную смесь разбавляют водой, серная кислота и алкилсульфаты переходят в раствор, а диалкилсульфат выделяется в виде нижнего слоя. Выход спиртов 96—97%, простого эфира образуется 1—2%.
Недостатком метода сернокислотной гидратации является участие в процессе больших объемов серной кислоты, ее разбавление, а отсюда необходимость ее упаривания, перекачки больших объемов, что связано с коррозией аппаратуры и большими капитальными затратами на сооружение заводов.
Следует отметить, что процесс сернокислотной гидратации олефинов позволяет проводить реакцию не с концентрированными
Образование простого эфира (III) возможно также путем взаимодействия (II) с водой:
Гидролиз проводят при давлении 0,4—0,5 МПа и температуре 92—95° С. Для уменьшения выхода эфира (III) гидролиз ведут по возможности быстро и образовавшийся спирт быстро отгоняют от смеси, чтобы его концентрация в растворе была небольшой. Можно поступать и иначе. Реакционную смесь разбавляют водой, серная кислота и алкилсульфаты переходят в раствор, а диалкилсульфат выделяется в виде нижнего слоя. Выход спиртов 96—97%, простого эфира образуется 1—2%.
Недостатком метода сернокислотной гидратации является участие в процессе больших объемов серной кислоты, ее разбавление, а отсюда необходимость ее упаривания, перекачки больших объемов, что связано с коррозией аппаратуры и большими капитальными затратами на сооружение заводов.
Следует отметить, что процесс сернокислотной гидратации олефинов позволяет проводить реакцию не с концентрированными