Классическое уравнение Михаэлиса-Ментен, которое после его публикации в 1913 г. стало фундаментальным в энзимологии при проведении кинетического анализа ферментативных процессов и которое до настоящего момента не претерпело существенных изменений. Формально оно соответствует изотерме Ленгмюра
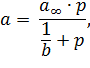
|
показывая, что фермент действует как гетерогенный катализатор.
Было показано, что оригинальное уравнение Михаэлиса-Ментен предполагает наличие нескольких ограничений. Оно справедливо, то есть верно описывает кинетику реакции, катализируемой данным ферментом, только при условии выполнения всех следующих ограничительных условий:
I. образуется кинетически устойчивый фермент-субстратный комплекс;
II. определенная с помощью уравнения Михаэлиса-Ментен константа является константой диссоциации фермент-субстратного комплекса;
III. ферментативный процесс протекает в условиях стационарного или квазистационарного режима;
IV. концентрация субстрата не меняется в ходе реакции (за время определения V0);
V. продукт реакции быстро отщепляется от фермента, то есть, нет значительной концентрации комплекса фермента и продукта (ЕР);
VI. вторая стадия необратима (из-за фактического отсутствия продукта на начальных стадиях процесса);
VII. реакция односубстратная;
VIII. для всех участников реакции применимы концентрации, а не активности.
Давайте разберем более подробно перечисленные условия, ограничивающие применение на практике уравнения Михаэлиса-Ментен.
I. Образование устойчивого фермент-субстратного комплекса. Старые теории, согласно которым фермент повышает энергию субстрата с помощью каких-либо телекинетических взаимодействий (электростатическое притяжение или отталкивание, электромагнитное излучение и т.д.) были убедительно опровергнуты. Наличие устойчивых фермент-субстратных комплексов для целого ряда ферментов подтверждено экспериментально. Поэтому первое условие, определяющее справедливость кинетики Михаэлиса-Ментен, можно считать справедливым для всех известных случаев. Однако касательно механизма образования фермент-субстратного комплекса существует несколько теоретических моделей:
- образование фермент-субстратного комплекса регулируется только диффузией субстрата (субстратов) к поверхности фермента. В этих случаях связывание определяется простой адсорбцией;
- образование фермент-субстратного комплекса описывается законами экстракции, часто это характерно для комплекса «фермент-ингибитор». Образование комплекса происходит за счет определенных функциональных групп и гидрофобных радикалов, благодаря создаваемому ферментом окружению, в котором субстрат (или активатор, ингибитор) может существовать на более низком энергетическом уровне.
Таким образом, в ходе ферментативной реакции образуется тот или иной тип фермент-субстратного комплекса, и скорость реакции будет зависеть от его стационарной концентрации.
II. Природа константы КM в уравнении Михаэлиса-Ментен. Бриггс и Холдейн показали в 1925, что исходное уравнение справедливо, если  , то есть, равновесие реакции
, то есть, равновесие реакции 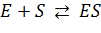 устанавливается очень быстро. Как видно из уравнения (1), константа Михаэлиса не является константой диссоциации или константой устойчивости фермент-субстратного комплекса.
устанавливается очень быстро. Как видно из уравнения (1), константа Михаэлиса не является константой диссоциации или константой устойчивости фермент-субстратного комплекса.
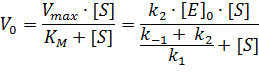
| (1) |
Согласно представлениям химии равновесных процессов, выражения для константы диссоциации (KS') и константы устойчивости (KS) фермент-субстратного комплекса будут иметь следующий вид:
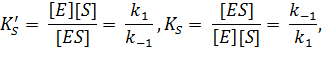
| (2) |
который отличает их от выражения для константы Михаэлиса (КM):
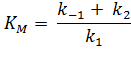
| (3) |
При определенных условиях реализации ферментативного процесса можно выделить 2 случая, когда выражение для константы Михаэлиса примет вид
1) 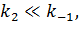 тогда выражение для константы Михаэлиса примет вид
тогда выражение для константы Михаэлиса примет вид 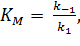 то есть, она соответствует константе устойчивости фермент-субстратного комплекса и обозначается как KS.
то есть, она соответствует константе устойчивости фермент-субстратного комплекса и обозначается как KS.
2) 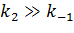 ,
,  тогда выражение для константы Михаэлиса примет вид
тогда выражение для константы Михаэлиса примет вид 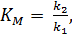 то есть, она определяется соотношением кинетических констант скорости отдельных элементарных реакций и не имеет прямого отношения к обратимому процессу образования фермент-субстратного комплекса и обозначается как KK.
то есть, она определяется соотношением кинетических констант скорости отдельных элементарных реакций и не имеет прямого отношения к обратимому процессу образования фермент-субстратного комплекса и обозначается как KK.
Таким образом, физический смысл константы Михаэлиса определяется не только природой участников реакции. Он может изменяться в разных условиях. Так, для пероксидазы хрена при изменении концентрационных параметров реагентов получаем:
- при высокой концентрации донора протонов: КM является KK;
- при средней концентрации донора протонов: КM есть КM;
- при низкой концентрации донора протонов: КM становится KS.
То есть, при протекании ферментативного процесса в условиях «быстрого равновесия» (кинетика Михаэлиса-Ментен) и в условиях «стационарного состояния» (кинетика Бриггса-Холдейна), для его описания подходит уравнение Михаэлиса-Ментен. Но физический смысл (природа) константы Михаэлиса может меняться в зависимости от концентрационных параметров процесса или от других факторов.