Таблица 1
| Время (t): |
| Температура (Т): |
В предварительном периоде должно установиться тепловое равновесие системы, которое характеризуется постоянным значением температуры. Сосуд открыть и всыпать навеску безводного сульфата меди‚ (m = 2,5г), быстро закрыть сосуд и интенсивно перемешать, встряхивая его. Во время главного периода происходит резкое изменение температуры. Заключительный период характеризуется установлением нового теплового равновесия. Раствор вылить и ополоснуть чистой водой.
По данным таблицы 1 построить графическую зависимость изменения температуры от времени для системы (Н2О + СuSO4) и по графику определить изменение температуры в ходе процесса ΔТ1.
Расчеты производить исходя из известного значения энтальпии растворения СuSO4 (ΔНраств. = – 66,53 · 103 Дж/моль). Рассчитать, сколько тепла должно выделиться в ходе опыта при растворении 2,5г соли (ΔН1 Дж). Используя экспериментальное значение ΔТ1.и уравнение (3), рассчитать значение теплоемкости калориметрической системы (С). Принять положительное значение теплоемкости.
ОПЫТ 2.2. Определение интегральной энтальпии растворения исследуемой соли.
Ход работы проводить аналогично опыту 2.1. Залить в сосуд также 200мл дистиллированной воды. После предварительного периода внести навеску соли (m = 2,5 г), быстро закрыть сосуд и встряхнуть. Показания термометра записать в таблицу 2.
Таблица 2
| Время (t): |
| Температура (Т): |
Построить графическую зависимость изменения температуры от времени для системы‚ (вода + соль) и из графика найти изменение температуры ΔТ2.
Расчеты производить в обратном порядке. Используя найденное в опыте 2.1 значение теплоемкости (С) и ΔТ2, рассчитать количество теплоты процесса Q2 (Дж). Вычислить молярную энтальпию растворения соли с учетом массы навески и молекулярной массы исследуемой соли (ΔН2, Дж/моль).
|
|
Опытное значение энтальпии растворения изучаемой соли сравнить с истинным значением (из справочника). Вычислить относительную ошибку определения.
ЗАДАЧИ.
1. При растворении 12,5 г КСl в 596 г воды температура понизилась на 1,04°С. Теплоемкость калориметра составляет 123 Дж/град, а удельная теплоемкость раствора 4,05 Дж/г град.
Рассчитать суммарную теплоемкость калориметрической системы и интегральную энтальпию растворения хлорида калия.
(Ответ; ΔН = 16,04 кДж/моль)
2. При сжигании 0,4362 г нафталина С10Н8 в калориметрической бомбе (металлический сосуд, заполненный кислородом) происходит повышение температуры на 1,707 градуса. Для нагревания калориметра на 1 градус необходимо внести 10,293 кДж/ тепла. Рассчитать энтальпию сгорания и энтальпию образования нафталина.
(Ответ: ΔНС = –5155,8 кДж/моль,
ΔНf = 77,6 КД/молъ).
ЛАБОРАТОРНАЯ РАБОТА № 2.
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫРАСТВОРЕННОГО
ВЕЩЕСТВА И ОСМОТИЧЕСКОГО ДАВЛЕНИЯ РАСТВОРА
КРИОСКОПИЧЕСКИМ МЕТОДОМ
Целью настоящей работы является:
1. Измерение температуры замерзания растворителя и раствора.
2. Определение молекулярной массы растворенного вещества и осмотического давления раствора.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Растворы обладают свойствами, отличными от свойств чистого растворителя. Такими свойствами являются: давление насыщенного пара, температура замерзания, температура кипения и осмотическое давление.
|
|
Давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем и зависит от концентрации раствора. Эта зависимость сформулирована Раулем: относительное понижение давления пара над раствором равно молярной доле растворенного вещества, то есть;
 (1)
(1)
где: Р0 – давление пара над чистым растворителем
Р – давление пара над раствором
ХА – молярная доля растворенного нелетучего вещества
Следует отметить, что этот закон выполняется только для идеальных и реальных разбавленных растворов.
Понижение давления пара над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
Температурой кипения называют температуру, при которой давление насыщенного пара над раствором станет равным внешнему давлению (Р атм.).
На рис. 1 этому состоянию соответствуют:
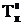 – температура кипения растворителя;
– температура кипения растворителя;
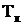 – температура кипения раствора.
– температура кипения раствора.
Разность между ними ΔТК = 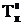 -
- 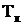 называется повышением температуры кипения.
называется повышением температуры кипения.
Повышение температуры кипения прямо пропорционально моляльной концентрации раствора:
ΔТК = Э·Сm (2)
где Э — эбулиоскопическая константа,
|

|
Рис. 1. Зависимость давления насыщенного пара растворителя от
температуры.
Температурой замерзания называют такую температуру, при которой давление пара над жидкостью станет равным давлению пара над твердой фазой. На рис.1 этому состоянию равновесия фаз соответствуют:
|
|
ТЗ0 температура замерзания чистого растворителя;
Т3 — температура замерзания раствора.
Понижение температуры замерзания прямо пропорционально моляльной концентрации раствора:
 (3)
(3)
где К – криоскопическая константа (для воды К=1,86).
Метод исследования растворов, основанный на измерении понижения температуры замерзания, называется киоскопическим.
Используя уравнение (3), можно рассчитать моляльную концентрацию растворенного вещества.
Если известны массы раствсрителя (m1) и растворенного вещества (m2), то уравнение (3) примет вид:
 (4)
(4)
Отсюда можно рассчитать молекулярную массу растворенного
вещества:
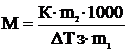 (5)
(5)
Криоскопический метод позволяет косвенно оценить осмотическое давление раствора, которое зависит от температуры и концентрации растворенного вещества:
Росм. =СМ · R · Т (6)
Для разбавленных водных растворов можно считать молярную концентрацию практически равной моляльной концентрации:
СМ ≈ Сm
Поэтому, зная понижение температуры замерзания раствора, можно рассчитать осмотическое давление по уравнению:
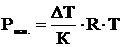 (7)
(7)
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 2.1. Определение температуры замерзания чистого
растворителя и раствора
Прибор для определения температуры замерзания состоит из стакана, двух вставленных одна в другую пробирок, термометра и мешалки (рис. 2).
|

Рис. 2. Прибор для определения температуры замерзания
В стакан помещают охлажденную смесь, приготовленную путем смешения льда и соли в соотношении 6:1.
Во внутреннюю пробирку наливают пипеткой 5 мл дистиллированной воды и погружают в нее термометр так, чтобы ртутный шарик полностью погружался в жидкость. Пробирку с термометром устанавливают в наружную пробирку, а затем в охлажденную смесь.
Внимательно следят за изменением температуры. Обычно жидкость переохлаждается, то есть ртуть в термометре опускается ниже температуры замерзания. Чтобы вывести жидкость из переохлажденного состояния, необходимо помешать ее мешалкой. При этом начинается процесс кристаллизации, сопровождающийся выделением скрытой теплоты кристаллизации, и ртуть в термометре быстро поднимается и держится на одном уровне. Это есть истинная температура замерзания, при которой жидкая и твердая фазы находятся в равновесии.
Кривая охлаждения растворителя показана на рис. 3.
Не рекомендуется переохлаждать жидкость более, чем на 1–1,5 градуса, т.к. скрытая теплота кристаллизации зависит от температуры.
Во избежание ошибок при определении опыт повторяют. Для этого внутреннюю пробирку вынимают из прибора, нагревают рукой до полного расплавления льда, затем снова помещают в прибор и охлаждают.
|
|
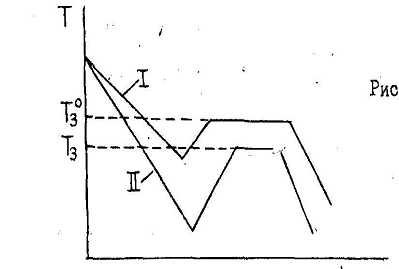
Рис. 3. Кривые охлаждения
После определения температуры замерзания растворителя, внутреннюю пробирку вынимают из прибора, нагревают до полного расплавления твердой фазы и вынимают термометр. Затем вносят в растворитель навеску исследуемой соли (m2), перемешивают до полного растворения, вставляют термометр и помешают пробирку в прибор, охлаждают.
Если растворитель замерзает при постоянной температуре и показания термометра длительное время не изменяются, то раствор замерзает в интервале температур (рис. 3, кривая II). Поэтому истинная температура замерзания раствора соответствует началу кристаллизации, то есть отмечают наивысшую температуру после выведения его из переохлажденного состояния. Опыт повторяют, добиваясь точности определения.
Результаты опытов заносят в таблицу 1.
Таблица 1.
| m1 | m2 | Тз0 | Тз | ΔТз | М | Росм. |
Рассчитать молекулярную массу растворенного вещества по формуле (5) и сравнить с истинным значением, рассчитать процент ошибки.
Рассчитать осмотическое давление раствора при Т = 298 К, используя значения газовой постоянной:
R = 831 л · Па / моль · К или
R = 0,082 л · атм / моль · К
Сравнить рассчитанное осмотическое давление раствора с осмотическим давлением полевых растений. Может ли исследуемый раствор служить питательной средой для них? В каком направлении будет протекать осмос?
ОПЫТ 2.2. Определение концентрации и осмотического давления
картофельного сока.
Сырой картофель измельчают и отжимают сок. В пробирку наливают 5-6 мл сока и определяют температуру замерзания.
Если использовать тот же термометр, что и в опыте 2.1., то значение температуры замерзания чистой воды можно считать известным.
Используя формулы (3) и (7), рассчитать концентрацию и осмотическое давление сока. Результаты определений вписать в таблицу 2.
Таблица 2.
| Температура замерзания воды ТЗ0 | Температура замерзания сока ТЗ | Понижение температуры замерзания ΔТз | Концентрация сока
Сm ( ) )
| Осмотическое давление Росм. (атм) |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Чем вызвано понижение температуры замерзания растворов?
2. Какой из методов: эбулиоскопический или криоскопический предпочтителен для исследования биологических объектов?
3. Какие важные свойства растворов позволяет определить криоскопический метод?
4. Имеются водные растворы мочевины, глицерина и фруктозы одинаковой моляльной концентрации. Отличаются эти температуры замерзания растворов?
5. Какие растворы называются изотоничными, гипертоническими, гипотоническими?
ЗАДАЧИ
1. Рассчитать, при какой температуре можно оставлять зимой автомобиль, если для охлаждения радиатора использовать в качестве антифриза 25% -ный водный раствор этиленгликоля СН2ОН - СН20Н.
2. Кровь человека замерзает при – 0,56 °С. Чему равно осмотическое давление крови при температуре тела 37 °С?
3. Осмотическое давление клеточного сока при 20 °С равно 6,85 атм. Рассчитать процентную концентрацию глюкозы, изотоничного с клеточным соком. Плотность раствора принять равной 1.
4. В 1 л крови здорового человека и больного диабетом содержится соответственно 1,80 и 1,85 г глюкозы. На сколько отличается осмотическое давление плазмы крови у этих людей? Почему чувство жажды у диабетиков проявляется сильнее, чем у здоровых людей?
ЛАБОРАТОРНАЯ РАБОТА №3
0ПРЕДЕЛЕНИЕ КОНСТАНТЫДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА МЕТОДОМ ЗЛЕКТРОПРОВОДНОСТИ
Целью настоящей работы является:
1. Ознакомление с методом электропроводности.
2. Изучение влияния концентрации на электрическую проводимость раствора слабого электролита.
3. Определение степени и константы диссоциации уксусной кислоты.
1. ТЕ0РЕТИЧЕСКАЯ ЧАСТЬ
Растворы электролитов относятся к проводникам второго рода. Метод электропроводности основан на измерении электрического сопротивления. Из физики известно, что сопротивление проводника зависит от природы и размеров проводника, что выражается формулой:
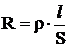 (1)
(1)
где ρ – удельное электрическое сопротивление,
l, S – длина и площадь проводника.
Величина, обратная удельному сопротивлению, называется удельной электрической проводимостью:
æ  (2)
(2)
Тогда уравнение (1) примет вид:
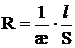 (3)
(3)
Для растворов электролитов рассчитывают молярную электрическую проводимость:
 (4)
(4)
Молярной электрической проводимостью называется электрическая проводимость объема раствора, содержащего 1 кмоль растворенного вещества и помещенного между электродами, находящимися на расстоянии 1 м друг от друга.
Молярная электрическая проводимость растворов электролитов зависит от концентрации, температуры, природы растворенного вещества и растворителя.
Рассмотрим влияние концентрации электролита. Поскольку растворы имеют ионную проводимость, то электрическая проводимость определяется количеством ионов в растворе и скоростью их движения
В бесконечно разбавленных растворах катионы и анионы движутся электрическом поле независимо друг от друга (закон Кольрауша), поэтому молярную электрическую проводимость такого раствора находят как сумму электролитических подвижностей катиона и аниона:
 (5)
(5)
В бесконечно разбавленных растворах слабых электролитов достигается также полная диссоциация молекул. то есть степень диссоциации молекул равна единице, тогда как в концентрированных растворах электролитическая проводимость зависит от степени диссоциации. Поэтому отношение молярной электрической проводимости исследуемого раствора к молярной электрической проводимости бесконечно разбавленного раствора показывает нам степень диссоциации:
 (6)
(6)
Для слабых электролитов, диссоциирующих по схеме
АВ А+ + В-
константа диссоциации выражается уравнением
 (7)
(7)
Равновесие концентрации аниона, катиона и молекул равны:



где С - концентрация электролита.
Рабочая формула для расчета константы диссоциации примет вид:
 (8)
(8)
Метод электропроводности может быть применен и для исследования растворов сильных электролитов, диссоциирующих полностью. Отношение молярных электрических проводимостей реального и гипотического бесконечно разбавленного, называемое коэффициентом электропроводности: характеризует межионное взаимодействие в растворах сильных электролитов:
 (9)
(9)
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
ОПЫТ 2.1. Подготовка прибора к работе и порядок измерений
В качестве прибора используют реоходный мост Р 38 и стеклянный сосуд с металлическими электродами.
В основе измерений лежит компенсационная схема, то есть подбирают сопротивление барабанного реохода так, чтобы компенсировать ток, проходящий через сосуд с электролитом.
Включают прибор в сеть, переключатель “питание” устанавливают в положение ~
Переключатель плеча сравнения устанавливают в положение «установка нуля», переключатель «гальв» в положение «точно», вращением корректора устанавливают стрелку гальванометра в нулевое положение, прибор отключают от сети.
Сосуд для измерений несколько раз ополаскивают дистиллированной водой и исследуемым раствором. Заливают сосуд так, чтобы электроды были погружены в жидкость, подключают его к клемам «Rх».
Переключатель плеча сравнения ставят в положение “100”, переключатель “гальв” в положение “грубо” и включают прибор в сеть. Вращение рукоятки реохода доводят стрелку гальваномотра до нуля. Показания реохода умножают на множитель 100. Получают значение в омах.
Переключатель “гальв” переводят в нейтральное положение и выключают прибор из сети.
ОПЫТ 2.2. Определение постоянной сосуда.
В ходе опыта размеры проводника остаются неизменными, поэтому их отношение называют постоянной сосуда:
П=  (10)
(10)
Для ее определения используют растворы КСl известной концентрации и удельной электрической проводимости (табл. 1).
Таблица 1.
| Температура, 0С | Концентрация КСl, моль/л | |
| 0,01: 0,02 | ||
| 0,11 | 0,22 | |
| 0,12 | 0,23 | |
| 0,12 | 0,23 | |
| 0,12 | 0,24 | |
| 0,12 | 0,24 | |
| 0,13 | 0,25 | |
| 0,13 | 0,26 | |
| 0,13 | 0,26 | |
| 0,14 | 0,26 | |
| 0,14 | 0,27 | |
| 0,14 | 0,28 |
Удельная электрическая проводимость растворов КСl (.æ,Ом-1·м-1) Заливают сосуд раствором КС1 и измеряют сопротивление. Рассчитывают постоянную сосуда по формуле
 æКСl
æКСl
ОПЫТ 2.3. Измерение электрической проводимости растворов
уксусной кислоты
В сосуд заливают 60 мл 0,1 н раствора уксусной кислоты и измеряют сопротивление. Затем отливают половину раствора из сосуда и доливают такой же объем дистиллированной воды и опять измеряют сопротивление. Разбавление повторяют еще два раза. Результаты измерений заносят в таблицу 2.
Расчеты производят по формулам:
Разбавление  , (11)
, (11)
удельную электрическую проводимость
æ  , (12)
, (12)
молярную электрическую проводимость по формулам (4) и (.5), степень диссоциации по формуле (.6) и константу диссоциации по формуле. (.8).
Подвижности. ионов при 25°С равны:


Влияние разбавления на электрическую проводимость раствора уксусной кислоты
Таблица 2.
| С, кмоль/м3 | V, м3/кмоль | R, Ом | æ, Ом-1·м-1 | λ, Ом-1·м2·кмоль-1 | α | К |
Расчеты можно производить на программируемых микрокалькуляторах, используя программу «Константа диссоциации” (табл.3)
По данным таблицы построить графическую зависимость молярной электрической проводимости от разбавления 
Сформулировать закон Разбавления Оствальда:
как изменяется при разбавлении степень и константа диссоциации уксусной кислоты.
Рассчитать среднее значение константы.
Программа «КОНСТАНТА ДИССОЦИАЦИИ»
Таблица 3
| Адрес | Команда | Код | Адрес | Команда | Код |
| Х–П5 | |||||
| СП | – | ||||
| Х–П2 | /–/ | ||||
| П–Х5 | Х–П4 | ||||
| П–Х1 | П–Х3 | ||||
| : | F Х2 | ||||
| СП | П–Х2 | ||||
| П–Х2 | Х | ||||
| : | П–Х4 | ||||
| СП | : | ||||
| П–Х6 | СП | ||||
| : | БП | ||||
| Х–П3 | |||||
| СП |
Последовательность операций:
1. Нажать «F ПРГ» и набрать программу,
2. Перейти в режим расчета «F АВТ. В/0»
3. Ввести в регистры памяти П (постоянная сосуда «Х–П5,
 Х–П6
Х–П6
4. Расчет:
| Ввод переменных (набрать число) | Команда (нажать) | Результаты (запись) |
| R1 | CП | |
| C1 | CП | æ1 |
| CП | λ1 | |
| CП | α1 | |
| CП | К1 | |
| R2 | СП | |
| С2 | СП | |
| и т.д. | æ2 |
ЗАДАЧИ:
1. Удельная электрическая проводимость очень чистой воды при 25°С равна 5,5 10-6 Ом–1·м-1. Предельная подвижность ионов Н+ и ОН- при этой температуре равна 35,0 и 19,8 Ом–1·м-1 ·кмоль-1 соответственно. Найти степень диссоциации воды, концентрацию ионов Н+, константу диссоциации и ионное произведение воды.
2. Удельная электрическая проводимость 0,1 н раствора КСl равна 1,28 Ом-1·м-1. Подвижности ионов К+ и Сl- соответственно равны 7,85 и 7,64 Ом-1·м2·кмоль-1. Рассчитать коэффициент электропроводности раствора.
3. Удельная электрическая проводимость водного раствора малорастворимой соли СdС2О4 равна 1,415 10-3 Ом–1·м-1, удельная электрическая проводимость дистиллированной воды равна 2·10-6 Ом–1·м-1. Подвижности ионов λ(Сd2+)=5,4 Ом–1·м-1, λ(С2О4-2)=7,4 Ом–1·м2 ·кмоль-1. Рассчитать произведение растворимости соли.
ЛАБОРАТОРНАЯ РАБОТА №4.
АДСОРБЦИЯ УКСУСНОЙ КИСЛОТЫИЗ РАСТВОРА
АКТИВИРОВАННЫМ УГЛЕМ
Цель работы:
1. Изучить влияние концентрации растворенного вещества на величину адсорбции при постоянной температуре;
2. Рассчитать постоянные изотерм Ленгмюра и Фрейндлиха.
I. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Молекулы, находящиеся в поверхностном слое, обладают избыточной энергией по сравнению с молекулами внутреннего слоя. Уменьшение свободной поверхностной энергии достигается за счет взаимодействия с молекулами других веществ. Явление самопроизвольного поглощения вещества на поверхности раздела фаз называется адсорбцией. Различают два типа адсорбции: физическую и химическую. Физическая адсорбция вызывается вандер-ваальсовыми силами молекулярного взаимодействия (ориентационные, индукционные и дисперсионные силы). Химическая адсорбция сопровождается образованием химических связей между адсорбентом и адсорбатом (хемосорбция).
Адсорбция может быть выражена количеством адсорбированного вещества (адсорбата) на единицу поверхности или массы адсорбента.
 или
или 
Кривая зависимости адсорбции от концентрации адсорбата при постоянной температуре называется изотермой адсорбции. Адсорбция на границе раздела уголь – раствор представляет собой сложный физико—химический процесс и зависит от многих факторов: природы адсорбента, природы растворителя и растворенного вещества, многообразия взаимодействий между адсорбентом и адсорбатом. Наиболее широко встречающиеся виды изотерм приведены на рис.
Изотерма адсорбции I показывает, что адсорбционные центры поверхности постоянно заполняются молекулами адсорбата и адсорбция стремится к пределу Гмакс, то есть образуется мономолекулярный слой. Для описания такого вида изотерм Ленгмюр предложил уравнение
 (2)
(2)
где: α константа уравнения.

Рис. 1 Изотермы адсорбции
Изотерма адсорбции 2 показывает, что адсорбция постепенно возрастает по экспоненциальному закону (полимолекулярная адсорбция). Такого рода изотермы описывает уравнение Фрейндлиха
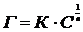 (3)
(3)
где: К и  - константы.
- константы.
Изотерму адсорбции 3 можно также описать уравнением Фрейндлиха, если принять n = 1
 (4)
(4)
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Установление зависимости величины адсорбции от концентрации для системы активированный уголь – раствор можно считать научным исследованием, поэтому требуется особая тщательность проведения эксперимента.
В четыре конические колбы наливают 50 мл раствора уксусной кислоты различной концентрации: 0,05 н., 0,1 н., 0,2 н., 0,4 н., и добавляют по 0,5 г угля. Растворы с углем встряхивают в течение 20 – 30 минут для установления адсорбционного равновесия. В это время уточняют начальную концентрацию уксусной кислоты (Со). Для этого отбирают пипеткой в колбу для титрования по 10 мл из первого и второго раствора и по 5 мл из третьего и четвертого раствора. Титруют 0,1 н раствором NаОН в присутствии фенолфталеина. Титрование повторяют до получения сходящихся результатов (разница не более 0,1 мл), усредняют их и рассчитывают концентрацию кислоты с точность до четвертого знака после запятой по уравнению
 (4)
(4)
После установления адсорбционного равновесия растворы с углем отфильтровывают, причем первые 5 мл фильтрата отбрасывают. В фильтрате титрованием определяют равновесную концентрацию уксусной кислоты (Ср).
Адсорбированное количество кислоты углем рассчитывают по уравнению
 (5)
(5)
где; СО, СР – начальные и равновесные концентрации кислоты
(моль/л),
V – объем раствора кислоты (мл),
m – масса угля (г).
Полученные результаты заносят в табл. 1
Таблица 1
| № п.п. | Начальная концентрация кислоты С0, моль/л | Равновесная концентрация кислоты СР | Адсорбция Г, ммоль/л | |
| моль/л | ммоль/л | |||
По данным табл.1 строят изотерму адсорбции, откладывая по оси абсцисс значения СР (ммоль/л), а по оси ординат Г (ммоль/г).
Графическое определение констант уравнений (2) и (З) трудоемко и неточно, поэтому рекомендуется проводить, обработку экспериментальных данных на ЭВМ. Для нахождения констант уравнения (2) использовать программу “Изотерма Ленгмюра”, для уравнения (З) использовать программу “Изотерма Фрейндлиха”. Записать полученные уравнения и рассчитать по ним значения Грасч. для указанных значений Ср., полученные данные свести в табл.2.
Таблица 2
| № п.п. | Адсорбция Г, ммоль/г | ||||
| опытные значения | Расчетные значения | ||||
| по Ленгмюру | ΔГ | по Фрейндлиху | ΔГ | ||
Рассчитать также отклонения расчетных значений от опытных (Г), а также сумму отклонений для двух уравнений. Сравнить их между собой и выбрать окончательно уравнение, лучше всего описывающее изученное явление.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что называется адсорбцией?
2. В каких единицах измеряется адсорбция?
3. С помощью каких уравнений можно описать адсорбцию растворенного вещества активированным углем?
ПРОГРАММА “ИЗОТЕРМА ЛЕНГМЮРА”
1. Установить режим программирования: Р ПРГ
2. Набрать программу (табл.3).
3. Установить режим вычислений; Р АВТ В/О
4. Ввести исходные данные: С1 СП Г1 СП, С2 СП Г2 СП и т.д.
5. Приступить к вычислению Гмакс: БП 25 СП.
6. Записать значение Гмакс.
Таблица 3
| Адрес | Команда | Код | Адрес | Команда | Код |
| F 1/х | Пх5 | ||||
| хП1 | х | ||||
| Пх2 | Пх2 | ||||
| + | Пх6 | ||||
| хП2 | х | ||||
| Пх1 | – | ||||
| Fх2 | Пх7 | ||||
| Пх3 | : | ||||
| + | F1/х | ||||
| хП3 | хП8 | ||||
| СП | СП | ||||
| F 1/х | |||||
| хП4 | Пх6 | ||||
| Пх5 | х | ||||
| + | Пх2 | ||||
| хП5 | Пх5 | ||||
| Пх1 | х | ||||
| Пх4 | – | ||||
| х | Пх7 | ||||
| Пх6 | : | ||||
| + | Пх8 | ||||
| хП6 | х | ||||
| СП | хП8 | ||||
| БП | |||||
| хП2 | |||||
| хП3 | |||||
| Пх3 | хП5 | ||||
| Х | хП6 | ||||
| Пх2 | Пх8 | ||||
| Fх2 | СП | ||||
| – | БП | ||||
| хП7 | |||||
| Пх3 |
7. Приступить к вычислению α
8. Записать значение α
ПРОГРАММА «ИЗОТЕРМА ФРЕЙНДЛИХА»
Таблица 4
| Адрес | Команда | Код | Адрес | Команда | Код |
| F lg | |||||
| хП1 | Пх3 | ||||
| Пх2 | х | ||||
| + | Пх2 | ||||
| хП2 | Fх2 | ||||
| Пх1 | – | ||||
| Fх2 | хП7 | ||||
| Пх3 | Пх3 | ||||
| + | Пх5 | ||||
| хП3 | х | ||||
| СП | Пх2 | ||||
| F lg | Пх6 | ||||
| хП4 | х | ||||
| Пх5 | – | ||||
| + | Пх7 | ||||
| хП5 | : | ||||
| Пх1 | F10х | ||||
| Пх4 | СП | ||||
| х | |||||
| Пх6 | Пх6 | ||||
| + | х | ||||
| хП6 | Пх2 | ||||
| СП | Пх5 | ||||
| БП | х | ||||
| – |