Титрование, использующееся в аналитической химии при титриметрическом анализе, в общем случае означает постепенное прибавление определенного количества реагента (например, раствора кислоты) к анализируемому раствору (например, щелочи). Титриметрический анализ представляет собой метод, основанный на измерении объема раствора с известной концентрацией (титрованного раствора), который расходуется на реакцию с даннымобъемом раствора неизвестной концентрации.
Целью кондуктометрического титрования является определение неизвестной концентрации раствора методом измерения его электропроводности в процессе титрования. При протекании химических реакций происходит обмен ионами, находящимися в растворе, вследствие чего меняется ионный состав раствора и соответственно его удельная электропроводность. Кондуктометрическое титрование чаще всего применяют для исследования реакций, в результате которых образуются нерастворимые или малорастворимые вещества. Этим методом можно исследовать даже мутные и сильноокрашенные растворы.
Общий вид зависимости электропроводности раствора щелочи от количества добавленной кислоты при титровании сильного основания сильной кислотой представлен на рис. 2.5. Точка пересечения двух прямых называется точкой эквивалентности. В этой точке вещества (кислота и щелочь) прореагировали в количествах, пропорциональных их эквивалентам. Для точки эквивалентности справедливо равенство
 (2.49)
(2.49)
где NK и NЩ — соответственно нормальность растворов кислоты и щелочи раствора); VK и VЩ — объемы растворов кислоты и щелочи, л.
Произведение (N∙V) представляет собой число г-эквивалентов вещества в данном объеме, так как нормальность N – эточисло г-эквивалентов растворенного вещества в 1 л раствора, а уравнение (2.49) аналитически выражает закон эквивалентов для растворов.

Рис. 2.5. Кривая кондуктометрического титрования
Вид кондуктометрической кривой легко объяснить на примере титрования раствора NaОH раствором HCl, при взаимодействии которых протекает реакция
NaOH + HCl = NaCl + Н2О;
Na+ + ОH- + Н+ + Cl- = Na++ Cl- + Н2О.
При добавлении в раствор щелочи соляной кислоты в ходе реакции происходит образование хлористого натрия NaClи Н2О. В связи с тем, что в водных растворах молекулы NaOH, HCl, NaCL практически нацело диссоциированы на ионы, в реакционной смеси ионы ОН- будут заменяться на ионы Cl-. Общее число заряженных частиц остается при этом постоянным. Как было показано выше, электропроводность раствора определяется скоростью движения ионов. Если сравнить подвижности указанных ионов, которые при 25oС равны следующим величинам
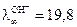 м2/(Ом∙кг-экв); а
м2/(Ом∙кг-экв); а  7,63 м2/(Ом∙кг-экв),
7,63 м2/(Ом∙кг-экв),
то становится очевидным, что замена ионов гидроксила на менее подвижные хлорид-ионы должно приводить к уменьшению электропроводности. Вода, являясь малодиссоциирующим соединением, не оказывет практического влияния на изменение электропроводности раствора. В точке эквивалентности (когда все количество щелочи прореагирует и все ионы гидроксила будут связаны в молекулы воды) электропроводность раствора станет минимальной, а затем за счет добавления избытка кислоты она начинает значительно расти. Это связано с тем, что начинает увеличиваться общее количество ионов в растворе, вводимых с избытком кислоты, которая диссоциирует согласно уравнению HCL ↔ Н+ + Cl-, кроме того, подвижность ионов Н+ является самой высокой, при 25oС она равна  /(Ом∙кг-экв).
/(Ом∙кг-экв).
Кондуктометрический метод используется также для определения растворимости малорастворимых электролитов. Если измерить удельную электропроводность раствора, содержащего малорастворимую соль, то, рассчитав значение эквивалентной электропроводности при бесконечном разведении  =
=  , можно определить концентрацию раствора по формуле
, можно определить концентрацию раствора по формуле
 . (2.50)
. (2.50)
Раздел II. ЭЛЕКТРОХИМИЯ